연구본부소개
-
58
체액 속에 숨겨진 정신질환의 비밀
- 고감도 정량검출이 가능한 바이오센서로 신경전달물질의 불균형을 측정 - 조현병, 우울증, 치매 등 다양한 정신 질환의 정확한 진단법으로 활용기대 과도한 스트레스와 평균수명의 증가로 현대인은 과거와 비교해 현저히 높은 비율로 조현병, 우울증, 불면증, 공황장애, 치매 등 다양한 형태의 정신질환을 앓고 있다. 그런데, 정신질환은 다른 질병과 달리 환자 행동과 판단에 기반해 의료진이 진단을 내리는 간접적인 진단법만을 활용하고 있어서 환자의 행동이상이 나타날 정도로 병이 진행된 상황에서만 진단이 가능했다. 또한 정밀한 진단을 위해 시행하는 MRI, CT, PET 검사 등은 비용이 비싸고 영상을 판독하는 과정에서 의사의 주관적인 판단이 개입된다는 문제가 있었다. 이에 뇌와 관련된 생체활동에 중요한 역할을 하는 체액 내 신경전달물질의 불균형을 정신질환의 지표로 활용하는 연구가 진행되었으나, 신경전달물질은 대부분 분자량이 매우 작고 유사한 화학구조를 가지고 있어 이를 선택적으로 검출하기 위해서는 액체 크로마토그래피 등 고가의 대형 장비와 전문인력이 필요했다. 한국과학기술연구원(KIST, 원장 윤석진) 생체분자인식연구센터 정영도, 이관희 박사팀은 체액에서 신경 전달물질들을 구분하고 정확한 양을 측정할 수 있는 바이오센서를 개발했다고 밝혔다. 연구팀은 신경전달물질이 선택적으로 흡착될 수 있는 다공성 재료인 전도성 MOF를 필름 형태로 제작해 현장형 전기신호 센서에 적용했다. 각 신경전달물질들은 그 크기, 전하세기, 화학결합 친화도의 차이에 따라 MOF에 흡착되는 정도가 다르기 때문에 신경전달물질의 종류와 양에 따라 특이적인 전기 신호의 패턴을 만드는 바이오센서를 만들 수 있었다. 이 바이오센서는 화학구조가 유사한 여러 종의 신경전달물질을 정확하게 구분했고, 고감도 정량검출이 가능하다. 예를들어 우울증 환자에게서는 세로토닌이, 파킨슨 병 환자에서는 도파민이 낮은 농도로 관찰되는데 본 시스템을 활용하면 다종의 바이오센서 없이 한번에 여러 신경전달 물질의 불균형을 측정할 수 있다. 연구진은 “개발된 기술은 신경전달물질의 정량적 분석결과를 기반으로 정신질환을 조기에 진단할 수 있다는 장점이 있다. 추후 임상중개 연구로 확장해 MRI, CT 등 추가의 정밀검사가 필요한 대상을 스크리닝 할 수 있는 검진기술로 개발할 예정이다.”라며 향후 계획을 밝혔다. 본 성과는 과학기술정보통신부 지원으로 한국연구재단 중견연구자지원사업, 범부처(과학기술정보통신부, 산업통상자원부, 보건복지부, 식품의약품안전처) 전주기의료기기연구개발사업단 KIST 출연금사업, KU-KIST, HY-KIST, 나노종합기술원 나노메디컬 디바이스 개발 사업의 지원을 받아 수행되었으며, 결과는 화학공학 권위지인 ‘Chemical Engineering Journal’(IF: 16.744, JCR 분야 상위 2.448%) 최신 호에 게재되었다. * (논문명) Modular conductive MOF-gated field-effect biosensor for sensitive discrimination on the small molecular scale - (제 1저자) 한국과학기술연구원 금창준 박사후연구원 - (제 1저자) 한국과학기술연구원 박성욱 박사후연구원 - (제 1저자) 한국과학기술연구원 김현노 연구원 - (교신저자) 한국과학기술연구원 이관희 책임연구원 - (교신저자) 한국과학기술연구원 정영도 선임연구원 ※ 논문 주소: https://doi.org/10.1016/j.cej.2022.141079 [그림 1] (좌) MOF가 도입된 반도체 기반 바이오센서의 구조 (우) 바이오센서를 활용하여 신경전달물질을 전기적 신호 패턴을 통해 구분한 결과. 구조가 매우 비슷한 다종의 신경전달물질은 MOF에 선택적으로 흡착되며, 이에 따라 다른 전기신호 패턴을 나타냄. 패턴 분석을 통해 각 신경전달물질을 구분하고 정량적으로 검출함.
- 57
- 작성자생체분자인식연구센터 정영도 책임연구원
- 작성일2023.02.14
- 조회수7290
-
56
삶의 질 높여줄 인공뼈 분말 제조 신기술 개발
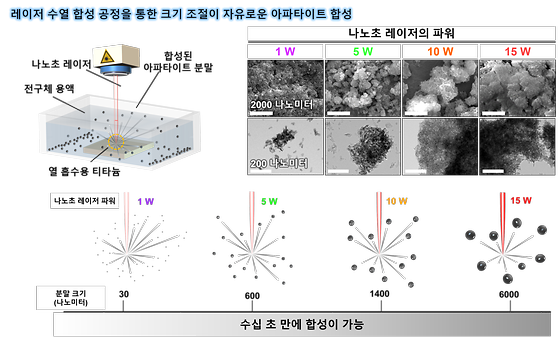
- 크기, 조성 조절 가능한 병변 맞춤형 생체재료 분말 제조 기술 - 상용화를 위한 KIST 기술출자회사 ㈜비엠포트 설립완료 노화는 우리몸의 장기를 손상하거나 기능을 저하시킨다. 과학·의료기술의 발달로 단순 수명은 증가했지만 노화로 인한 질환, 그 중에서도 특히 근골격계 질환은 운동능력을 감소시키고 이동을 어렵게 해 삶의 질을 위협한다. 이 때문에 최근에는 수명연장 그 자체보다도 건강수명 증가에 관심이 모아지고 있으며, 골격계 질환을 극복하기 위해 신체를 대체하거나 보강해줄 수 있는 인공재료에 대한 연구도 그와 관련된 연구개발 분야 가운데 하나이다. 한국과학기술연구원(KIST, 원장 윤석진) 생체재료연구센터 전호정 박사팀은 레이저를 활용해 다양한 기능성을 가진 인공뼈 분말인 아파타이트를 수십 초 만에 합성해내는 합성 공정 기술을 개발했다고 밝혔다. 기존의 열수화 인공뼈 분말 합성 기술은 200㎚(나노미터) 크기의 분말을 얻기 위해 짧게는 20시간에서 길게는 100시간 이상의 시간이 필요했다. 그런데 이번에 연구진이 개발한 레이저 수열 합성공정을 사용하면 작게는 30㎚부터 크게는 200배에 달하는 6㎛(마이크로미터) 크기의 분말까지 10여 분 만에 합성할 수 있고, 손쉽게 칼슘의 일부를 마그네슘, 아연 등의 금속이온으로 대체한 기능성 인공뼈 분말 제조가 가능해진 것이다. 이번에 개발된 기술은 기존 열수화 공정 대비 레이저 펄스의 시간에 해당하는 수 ㎱(나노초) 동안 1000℃ 이상의 초고온에서 합성 공정이 진행되기 때문에 마그네슘, 스트론튬, 아연과 같은 기능성 금속이온을 보다 쉽게 대체할 수 있는 장점이 있다고 연구진은 설명했다. 이를 바탕으로 하이드록시 아파타이트 뿐만 아니라 뼈를 구성하는 성분 중 재생에 중요한 인자라고 생각되는 ‘휘트록카이트’를 동일 시간동안 10배 더 큰 마이크로미터 사이즈로 합성 할 수 있었다. 휘트록카이트는 주로 어린아이들의 뼈에서 많이 관찰되는 물질로 마이크로미터 사이즈의 휘트록카이트는 인공뼈로 주로 활용중인 하이드록시 아파타이트를 대신 할 것으로 기대된다. 또한, 연구진은 레이저 수열 합성기술로 만든 인공뼈 재료가 실제 뼈세포에 어떠한 영향을 미치는지 확인하기 위하여 세포 실험을 진행한 결과 현재 상용화된 제품으로 판매되고 있는 인공뼈 분말 대비 2배 뛰어난 세포 부착 능력과 세포 증식 능력을 나타내는 것을 확인했다. 전호정 박사는 “본 연구에서 개발한 재료가 상용화된 재료보다 뛰어난 성능을 보이는 이유는 초고온에서 반응이 일어나는 레이저 수열 합성의 과정을 고려하였을 때 합성된 분말이 자연스럽게 녹을 수 있는 ‘생분해성’을 가지기 때문”이라며, “이 기술을 기반으로 KIST 출자 연구소기업 ‘주식회사 비엠포트(대표 손진경)’를 지난 9월 13일 설립했으며, 향후 인공뼈, 피부 미용용도의 필러 등의 분야에서 상용화를 추진할 예정”이라고 밝혔다. 본 연구는 과학기술정보통신부(장관 이종호) 지원으로 KIST, KU-KIST 주요사업과 한국연구재단 중견연구자지원사업으로 수행되었으며, 이번 연구결과는 나노소재 분야 국제 저널인 ‘ACS NANO’ (IF: 18.027, JCR 분야 상위 5.652%) 온라인 상에 게재되었다. * (논문명) Rapid synthesis of multifunctional apatite via the laser-induced hydrothermal process - (제 1저자) 한국과학기술연구원 송상민 학생연구원 - (제 1저자) 한국과학기술연구원 엄승훈 박사후연구원(現, Laval University) - (교신저자) 서울대학교 기계공학부 고승환 교수 - (교신저자) 한국과학기술연구원 김유찬 책임연구원 - (교신저자) 한국과학기술연구원 전호정 책임연구원 [그림 설명] [그림 1] 레이저 수열 합성 공정을 통한 크기조절이 자유로운 아파타이트 합성 [그림 2] 레이저 수열 합성 공정의 과정
- 55
- 작성자생체재료연구센터 전호정 박사팀
- 작성일2022.10.21
- 조회수7280
-
54
접혔다 펴졌다 암세포를 직접 뚫는 나노머신 개발
- 분자의 기계적 움직임으로 세포에 침투하여 사멸시키는 '나노머신' 개발 - 암세포 근처에서만 풀리는 걸쇠 분자를 이용하여 암세포만 선택적으로 침투 단백질은 몸 안에서 에너지를 활용해 기계적 움직임으로 구조를 변화하고 생명현상에 관여한다. 단백질의 아주 작은 구조적 변화까지도 생명현상에 지대한 영향을 끼치기 때문에 단백질은 생물학적 ‘나노머신’에 비유된다. 이런 단백질을 모사한 나노머신을 개발하여 세포 환경에서 움직임을 구현하고자 하는 시도는 최근에 많은 조명을 받고 있다. 하지만, 나노머신으로 의미있는 움직임을 구현하고, 이를 의약학적으로 적용하려는 시도는 세포가 스스로를 보호하려는 다양한 기작들로 인해 어려움을 겪고 있다. 한국과학기술연구원 (KIST, 원장 윤석진) 생체분자인식연구센터 정영도 박사팀은 울산과학기술원(UNIST, 총장 이용훈) 에너지화학공학과 곽상규 교수팀, 화학과 유자형 교수팀, 퓨전바이오텍의 김채규 박사와의 공동연구를 통해 암세포 등 특정 세포 환경에서 접힘, 펴짐 등 분자의 움직임을 통해 세포막을 뚫고 침투해 세포를 죽이는 새로운 방식의 생화학적 나노머신을 개발했다고 밝혔다. 공동연구팀은 단백질의 계층적 구조에 주목했다. 단백질은 거대 구조의 축과 실제 움직이는 부분이 계층적으로 분리되어 축을 중심으로 특정 부분만 의도적으로 움직일 수 있다. 하지만 움직이는 부분과 축이 같은 계층에 있도록 설계된 대부분의 기존 나노머신의 경우 동시에 두 부분이 같이 움직이게 되어 특정 부분을 의도대로 조종하기 어려웠다. 연구진은 2nm 수준의 금나노입자와 주변 환경에 따라 접히고 펴질 수 있는 분자를 각각 합성하고 결합해 계층적 구조의 나노머신을 만들었다. 이 나노머신은 움직이는 유기분자와 축이 되는 거대 구조인 무기나노입자로 움직임과 방향을 정의해 세포막을 만나면 접히고 펴지는 기계적 움직임을 보였고 세포에 직접 침투해 세포소기관을 망가뜨려 사멸을 유도했다. 이러한 방식은 치료용 약물을 전달하는 방식의 캡슐형 나노 전달체와 달리 항암제를 사용하지 않고 기계적 움직임을 통해 암세포를 직접 죽이는 새로운 방식이다. 연구팀은 한발 더 나아가 나노머신의 암세포 사멸에 더욱 적합하게 기계적 움직임을 제어하기 위해 걸쇠 분자를 나노머신에 끼워넣었다. 끼워넣은 걸쇠 분자는 낮은 pH 환경에서만 풀리도록 설계해 상대적으로 pH가 높은 정상 세포(pH 7.4 내외)에서는 나노머신의 움직임이 제한되어 세포안으로 침투 할 수 없었다. 하지만 암세포 주변(pH 6.8 내외)의 낮은 pH에서 나노머신은 걸쇠 분자가 풀려 기계적 움직임이 유도되고 암세포에 침투하는 결과를 확인했다. KIST 정영도 박사는 “개발한 나노머신은 단백질들이 환경에 따라 형태를 바꾸어 생물학적 기능을 수행하는 것에서 아이디어를 얻었다. 약물 없이 나노머신에 붙은 분자의 기계적 움직임으로 직접 암세포에 침투하여 사멸시키는 새로운 방식을 제시하였고, 기존 항암치료의 부작용을 극복할 수 있는 새로운 대안이 될 수 있다.” 라고 밝혔다. 이번 연구는 과학기술정보통신부(장관 임혜숙)의 지원을 받아 KIST의 주요사업과 한국연구재단 중견 연구자 사업 및 바이오의료기술사업으로 수행되었으며, 연구 결과는 화학 분야의 권위지인 ‘Journal of the American Chemical Society’ (IF: 15.42) 최신 호에 게재 및 Supplementary Cover에 선정되었다. * (논문명) Stimuli-Responsive adaptive nanotoxin to directly penetrate the cellular membrane by molecular folding and unfolding - (제 1저자, 교신저자) 한국과학기술연구원 정영도 선임연구원 - (교신저자) 울산과학기술원 곽상규 교수 - (교신저자) 퓨전바이오텍 김채규 박사 - (교신저자) 울산과학기술원 유자형 부교수 그림설명 [그림 1] 암세포만 골라 침투하여 죽이는 나노머신과 그 작동원리 [그림 2] 암세포에 분자의 기계적 움직임을 이용하여 세포 속으로 직접 침투하고, 세포내 소기관을 망가뜨려 암 세포를 죽이는 나노머신
- 53
- 작성자생체분자인식연구센터 정영도 박사팀
- 작성일2022.03.21
- 조회수8285
-
52
저전력·고효율 인공 뉴런 소자 개발
- 3T-OTS소자로 인간 두뇌 효율적인 정보처리 방식 모사 - 센서-AI 결합 차세대 인공지능 개발 청신호 “생명·안전 분야 활용 기대” 현재 일상과 산업 전반에서 빠르게 확산되고 있는 인공지능 서비스는 대부분 인터넷을 통해 AI 센터와 모바일·PC 등의 단말기를 연결하는 방식이다. 그런데 이러한 방식은 AI 시스템의 구동은 물론 데이터 전달 과정에서도 많은 전력을 사용해 환경에 부담을 가중시키고, 전쟁과 재난 상황에서는 전력·통신망 붕괴로 무용지물이 될 수도 있다. 특히 생명·안전 분야의 AI 서비스라면 문제는 더욱 심각해질 수도 있다. 이러한 약점을 극복할 수 있는 차세대 인공지능 기술로 자연 상태의 저전력·고효율 컴퓨터라 할 수 있는 인간 신경계의 정보처리 메커니즘을 모방하는 ‘인-센서(in-sensor) 컴퓨팅’ 기술이 주목 받고 있다. 한국과학기술연구원(KIST, 원장 윤석진)은 인공뇌융합연구단 이수연 박사팀이 인-센서 컴퓨팅 실용화의 열쇠가 될 ‘인공감각 뉴런소자’ 개발에 성공했다고 밝혔다. 뉴런은 눈·코·입·귀·피부 등의 감각기관이 받아들이는 방대한 외부 자극을 일차적으로 스파이크(spike) 형태의 정보로 정제해 두뇌가 인지·학습·추론·예측·판단 등의 복잡한 작업을 적은 에너지로도 신속하게 통합 수행할 수 있도록 하는 데 중요한 역할을 한다. OTS 소자는 2단자로 구성된 스위칭 소자로, 스위칭 전압 이하에서는 높은 저항 상태(10~100 MΩ)를 유지하고, 스위칭 전압 이상에서는 급격한 저항 감소를 보이는 특성을 가진다. 이러한 OTS의 저항 스위칭 특성을 이용한 선행연구에서, 연구팀은 입력되는 신호가 특정 세기를 넘어설 때 스파이크 신호를 발생시키는 뉴런의 동작(integrate-and-fire)을 흉내 내는 인공 뉴런 소자를 개발하였다. 본 연구에서는 더 나아가, 감각기관에 입력되는 방대한 데이터 사이에서 빠르게 패턴을 찾아내 추상화하는 뉴런의 거동을 모사하기 위해 스위칭 전압을 제어할 수 있는 3단자 OTS(Ovonic Threshold Switch) 소자를 개발했다. 3단자 OTS 소자의 제3 전극에 외부 자극을 전압으로 변환하는 센서를 연결함으로써 외부 자극에 따라 스파이크 신호의 형태가 달라지는 감각 뉴런 소자를 구현할 수 있었다. 연구진은 이 같은 3단자 OTS 소자를 광전 변환 센서와 연결해 인체 감각기관의 정보처리 방식을 흉내 내는 인공시각 뉴런소자를 구현하는 데 성공했다. 또한, 인공 시각 뉴런 소자를 두뇌의 시각 중추를 모사한 인공 신경망과 연결하여 폐의 X-ray 이미지 학습을 통해 86.5%의 정확도로 코로나19와 바이러스성 폐렴을 구별할 수 있음을 보였다. KIST 인공뇌융합연구단 이수연 단장은 “이번에 개발한 인공감각 뉴런소자는 기존 센서와 연결하여 시각, 촉각 등 다양한 감각 뉴런소자를 구현할 수 있는 플랫폼 기술로, 인-센서 컴퓨팅 기술 분야에서 매우 중요한 기술”이라고 밝혔다. 이와 함께 “검사와 동시에 진단이 가능한 의료영상 진단시스템 개발, 맥박이나 혈압의 시계열 패턴 분석을 통한 급성 심장질환의 예측, 가청 주파수 바깥의 진동을 감지해 건축물 붕괴 사고나 지진, 쓰나미 등을 예방하는 초감각의 구현 등 특히 생명·안전과 관련된 다양한 사회 문제 해결에 많은 기여를 할 것”이라고 연구 의의를 설명했다. 이번 연구는 KIST 기본연구사업, 한국연구재단 미래반도체 신소자 원천기술개발사업 및 차세대지능형반도체 기술개발사업의 지원을 받아 수행되었으며, 연구 결과는 나노 분야 저널인 ‘Nano Letters’ (IF: 11.189, JCR 분야 상위 9.062%) 최신호에 게재되었다. * (논문명) Three-Terminal Ovonic Threshold Switch (3T-OTS) with Tunable Threshold Voltage for Versatile Artificial Sensory Neurons - (제 1저자) 한국과학기술연구원 이혜진 학생연구원 - (교신저자) 한국과학기술연구원 이수연 책임연구원 그림 설명 [그림 1] 시각 뉴런 소자의 개발 및 이를 인공지능 기술과 결합한 인-센서 컴퓨팅 기술 구현 (하나의 예시로서, 폐 x-ray 이미지 학습을 통한 COVID-19 진단)
- 51
- 작성자인공뇌융합연구단 이수연 박사팀
- 작성일2022.03.07
- 조회수6913
-
50

코로나바이러스, 변이에 상관없이 현장에서 검출한다
- PCR 감도로 30분 내에 변이 코로나바이러스도 검출 가능한 시스템 개발 - 코로나바이러스의 물리적 특성을 모사한 안전한 합성 바이러스 활용 델타 변이에 이어 전염성이 매우 강한 오미크론 변이가 등장하는 등 코로나바이러스 변이와 확산세가 꺾이지 않고 있다. 이처럼 수많은 변종이 발생하는 코로나바이러스의 경우 확산을 막기 위해서는 변이 바이러스를 빠르고 정확하게 검출할 수 있는 진단 플랫폼 개발이 필수적이다. 한국과학기술연구원(KIST, 원장 윤석진) 생체재료연구센터 이관희 박사, 김호준 박사팀은 변이에 상관없이 코로나바이러스를 현장에서 30분 내에 PCR 수준의 감도로 검출할 수 있는 바이오센서 플랫폼을 개발했다고 밝혔다. 현재 유전자 기반의 PCR 진단은 최소 수 시간이 필요하며, 수검자는 결과가 나올 때까지 격리해야 한다. 또한 PCR 검사는 특정 유전자 서열이 존재해야만 진단이 가능하기 때문에 다른 유전자 서열을 갖는 변이종의 경우 진단능력이 감소할 수밖에 없다. 최근 널리 활용중인 간이 검사키트의 경우에도 특정 단백질 구조에 반응하는 항체를 키트에 넣어 반응하는 방법으로 바이러스를 확인하기 때문에 변이 바이러스 진단에는 한계를 보이고 있다. 이러한 문제를 해결하기 위해 연구팀은 우리 몸에 존재하는 코로나바이러스의 감염 수용체인 ACE2에 주목했다. 변이 바이러스일지라도 인체에 침투하기 위해서 ACE2와 결합하기 때문에, ACE2를 적용한 고감도 바이오센서로 바이러스의 범용적 검출이 가능할 것이라 생각했다. 이를 위해 ACE2 수용체와 결합된 전기신호 기반의 현장형 반도체 바이오센서 플랫폼을 제작하고, 코로나바이러스의 물리적 특성을 모사한 바이러스를 합성하여 바이오센서 플랫폼을 최적화 하였다. 이렇게 개발된 바이오센서 플랫폼으로 진단한 결과, 실제 코로나바이러스 및 합성된 다양한 변이 바이러스를 현재 이루어지고 있는 PCR 검사수준 (165 copies/mL, 30분 내)의 감도로 현장에서 실시간으로 검출하는데 성공하였다. 이관희 박사는 “ACE2 수용체와 고감도 반도체 바이오센서를 결합하는 기술로 현장에서 변이 바이러스를 검출할 수 있는 진단 시스템의 개발을 가능하게 했다. 빠른 시일 내에 센서 표준화와 규격화를 거쳐 상용화할 예정이며, 이는 감염 예방 시스템 및 사회적 안전망 구축에 기여할 것으로 기대한다”고 밝혔다. 김호준 박사는 “본 연구를 통해 개발한 합성 바이러스의 경우 감염력이 없기 때문에 BSL레벨이 낮은 곳에서도 취급이 가능하고 다른 바이러스 진단 플랫폼 연구에도 활용이 가능하다는 장점이 있다. 합성 바이러스를 활용한 고감도 정밀 검출 플랫폼 최적화 등에 대한 연구를 지속할 예정이다.”고 말했다. 본 성과는 KIST 기본연구사업, 한국연구재단 중견연구자지원사업, 범부처 전주기의료기기연구개발사업단의 지원을 받아 수행되었으며, 연구 결과는 나노분야 권위지인 ‘나노레터스(Nano Letters)’ (IF: 11.189, JCR 분야 상위 9.062%) 최신 호에 게재되었다. * (논문명) SARS-CoV-2 Variant Screening Using a Virus-Receptor-Based Electrical Biosensor - (제 1저자) 한국과학기술연구원 박성욱 박사후연구원 - (제 1저자, 교신저자) 한국과학기술연구원 김호준 선임연구원 - (교신저자) 한국과학기술연구원 이관희 책임연구원 그림 설명 <span style="color: rgb(85, 85, 85); font-size: 14pt; font-style: inherit; font-variant-ligatures: inherit; font-variant-caps: inherit; font-weight: inherit; background-color: rgb(255, 255, 255); font-family: 나눔고딕코딩, NanumGothicCoding, sans-serif;" \\b098눔고딕",="" nanumgothic,="" sans-serif,="" meiryo;="" white-space:="" pre-wrap;"="">[그림 1] 코로나바이러스의 감염 통로 수용체인 ACE2를 활용한 초고감도 반도체 바이오센서 플랫폼 개발을 통해 <span style="color: rgb(85, 85, 85); font-size: 14pt; font-style: inherit; font-variant-ligatures: inherit; font-variant-caps: inherit; font-weight: inherit; background-color: rgb(255, 255, 255); font-family: 나눔고딕코딩, NanumGothicCoding, sans-serif;" \\b098눔고딕",="" nanumgothic,="" sans-serif,="" meiryo;="" white-space:="" pre-wrap;"="">PCR 수준의 감도로 코로나바이러스 검출 성공 <span style="color: rgb(85, 85, 85); font-size: 14pt; font-style: inherit; font-variant-ligatures: inherit; font-variant-caps: inherit; font-weight: inherit; background-color: rgb(255, 255, 255); font-family: 나눔고딕코딩, NanumGothicCoding, sans-serif;" \\b098눔고딕",="" nanumgothic,="" sans-serif,="" meiryo;="" white-space:="" pre-wrap;"="">(실제 코로나바이러스 샘플 활용) <span style="color: rgb(85, 85, 85); font-size: 14pt; font-style: inherit; font-variant-ligatures: inherit; font-variant-caps: inherit; font-weight: inherit; background-color: rgb(255, 255, 255); font-family: 나눔고딕코딩, NanumGothicCoding, sans-serif;" \\b098눔고딕",="" nanumgothic,="" sans-serif,="" meiryo;="" white-space:="" pre-wrap;"=""> <span style="background-color: rgb(255, 255, 255); color: rgb(85, 85, 85); font-family: 나눔고딕코딩, NanumGothicCoding, sans-serif; font-size: 14pt;" \\b098눔고딕",="" nanumgothic,="" sans-serif,="" meiryo;="" font-size:="" 13px;="" text-indent:="" 0px;="" white-space:="" pre-wrap;"="">[그림 2] 초고감도 반도체 기반의 바이오센서 플랫폼의 검출 모식도 및 코로나19 변이 바이러스 검출 결과 <span style="background-color: rgb(255, 255, 255); color: rgb(85, 85, 85); font-family: 나눔고딕코딩, NanumGothicCoding, sans-serif; font-size: 14pt;" \\b098눔고딕",="" nanumgothic,="" sans-serif,="" meiryo;="" font-size:="" 13px;="" text-indent:="" 0px;="" white-space:="" pre-wrap;"="">(Wild 및 Delta plus, Kappa 변이의 합성 바이러스)
- 49
- 작성자생체재료연구센터 이관희 박사, 김호준 박사팀
- 작성일2022.01.26
- 조회수9372
-
48
미세먼지와 뇌건강의 연결고리를 밝히다
- 같은 농도의 탄소 미세먼지도 구조에 따라 뇌에 끼치는 영향이 상이 <p class="se-text-paragraph se-text-paragraph-align-justify " id="SE-3c78355e-590f-4353-9549-3d48007bb580" style="border: 0px; font-variant-numeric: inherit; font-variant-east-asian: inherit; font-stretch: inherit; font-size: 0px; line-height: 1.5; font-family: se-nanumgothic, " \\b098눔고딕",="" nanumgothic,="" sans-serif,="" meiryo;="" vertical-align:="" baseline;="" word-break:="" break-word;="" overflow-wrap:="" color:="" rgb(60,="" 63,="" 69);="" background-color:="" rgb(255,="" 255,="" 255);="" text-align:="" justify="" !important;"="">- 이와 관련된 핵심 유전자 발견-향후 뇌질환 치료제 개발로 응용 기대 최근 국내 미세먼지 농도가 급증함에 따라 미세먼지가 인체에 미치는 영향에 대한 관심이 높아지고 있다. 그러나 미세먼지 연구는 황산염, 질산염, 탄소류 등 성분에 대한 연구가 주를 이루고, 뇌에 끼치는 영향에 대한 연구는 아직 부족해 정확한 대처나 치료가 어려운 실정이다. 특히 미세먼지 중 20~50%를 차지하고 있는 탄소 미세먼지의 경우 0~3차원까지 다양한 구조가 있으나 ‘탄소류’라는 한 개의 주제로 연구가 진행되어 흡입에 대한 원천적 차단만을 권고하고 있었다. 이러한 가운데 한국과학기술연구원 (KIST, 원장 윤석진) 생채재료연구센터 이효진 박사, 도핑콘트롤센터 김기훈 박사, 뇌과학창의연구단 김홍남 박사 연구팀은 탄소 나노입자의 구조를 제어해 같은 탄소 성분이더라도 구조에 따라 생체기능에 미치는 영향이 다르다는 것을 밝히고 이 과정에서 뇌 손상에 관여하는 핵심 유전자를 발굴했다. 연구진은 탄소 미세먼지와 유사한 다양한 차원(0~3차원)의 탄소 나노재료를 합성해 국내 초미세먼지 기준 ‘나쁨’에 해당하는 농도(50μg/m3)로 신경세포에 처리하고 신경전달물질의 변화를 살펴보았다. 0차원 탄소입자는 장기간 노출시에도 신경세포의 과활성이나 사멸을 유도하지 않았다. 그러나 고차원(3차원)의 탄소입자는 단기간(72시간 이내)의 노출만으로도 신경세포의 비정상적 활성상태를 유도해 과도한 신경전달 물질이 분비되었으며, 장기간(14일) 노출시 신경세포는 사멸되었다. 더욱 흥미로운 점은 치매와 밀접한 관련이 있는 아밀로이드 베타 단백질이 존재할 때에 이러한 현상이 더욱 가속화된다는 점이었다. 이를 바탕으로 같은 농도의 미세먼지이더라도 일반인 보다 퇴행성 뇌질환 환자에 더욱 치명적이게 작용할 수 있다는 것을 알 수 있었다. 연구진은 더 나아가 고차원 탄소입자가 신경세포의 과활성을 유도하는 원인을 밝히기 위해 유전자 분석을 진행한 결과 Snca 유전자가 핵심적으로 관여하고 있다는 것을 발견하였다. 유전자 가위 방법을 통해 이 유전자를 제거하고 동일한 농도의 탄소 미세먼지를 처리하자 비정상적 신경 과활성이 일어나지 않는 것을 확인하였다. 이러한 유전 핵심 인자 발굴은 미세먼지에 농도에 따른 뇌 건강을 확인할 수 있는 지표로 사용할 수 있을 뿐만 아니라 향후 치료물질 도출 및 약물 개발에도 응용 가능할 것으로 기대된다. KIST 이효진 박사는 “본 연구를 통하여 미세먼지가 뇌에 특히 퇴행성 뇌질환자에 미칠 수 있는 영향을 보다 정확히 파악할 수 있었다.”라며 “향후 연구의 범위를 확장하여 미세먼지가 다양한 조직 및 질병에 미치는 영향에 대한 연구를 진행해 맞춤형 치료가 가능할 수 있는 방법을 모색할 계획이다.”라고 밝혔다. 본 연구는 과학기술정보통신부(장관 임혜숙) 지원으로 KIST 주요사업과 한국연구재단 신진연구자지원사업 및 중견연구자지원사업으로 수행되었으며, 연구 결과는 생체재료 분야 국제학술지 ‘Biomaterials’ (JCR 분야 상위 2.778%) 최신 호에 게재되었다. * (논문명) Effect of carbon nanomaterial dimension on the functional activity and degeneration of neurons - (제 1저자) 한국과학기술연구원 김성찬 위촉연구원, 황경섭 학생, 임누리 학생 - (교신저자) 한국과학기술연구원 이효진, 김기훈, 김홍남 선임연구원 그림 설명
- 47
- 작성자생채재료연구센터 이효진 박사, 도핑콘트롤센터 김기훈 박사, 뇌과학창의연구단 김홍남 박사팀
- 작성일2021.12.16
- 조회수9652
-
46
손상된 근육치료를 위한 외부 세포 치료법의 획기적 전기 마련
- 최종 사용자인 임상의가 접근하기 쉬운 간편한 배양 플랫폼 개발 - 근골격계 세포에도 적용 가능한 세포 치료제 원료 획득 원천기술 확보 국내 연구진이 외상 후 본인의 다른 신체부위 근육이 아닌 체외에서 별도로 세포를 배양해서 치료에 이용할 수 있는 기술을 개발했다. 한국과학기술연구원(KIST, 원장 윤석진)은 생체재료연구센터 한형섭 박사, KIST 유럽 환경안전성연구단 전인동 박사 연구팀이 고려대학교 의과대학(총장 윤영욱) 송재준 교수팀과의 공동연구를 통해 체내 근육 조직과 유사한 물리적 환경을 모방할 수 있는 차세대 세포배양 플랫폼을 흔히 쓰이는 플라스틱 배양접시를 이용해 개발하여, 치료 효능을 갖춘 고품질 세포를 생산하는 데 성공했다고 밝혔다. 근육은 자가 재생능력이 있으므로 일정 수준 이하의 외상은 자체적으로 치유된다. 그러나 치명적인 외상의 경우에는 자체 치유가 어렵기 때문에 환자의 몸에서 직접 채취한 근육세포를 이식하는데, 이 경우 환자의 건강한 근육을 손상시켜야 한다. 외부에서 근육세포를 배양하여 이식할 수도 있지만, 이 경우 임상에서 잘 쓰이지 않을만큼 세포 생존율 및 치료 효능이 낮다는 한계가 있었다. 연구진은 고품질의 근육 세포를 확보하기 위해 체내 환경을 모사한 배양 플랫폼을 제작했다. 연구자 및 임상의 누구나 쉽게 활용이 가능한 상용 플라스틱 세포 배양 접시 표면에 비접촉식 레이저 가공을 통해 체내 근육 조직과 유사한 표면 구조를 만들고, 탈부착식 전기장 자극 시스템을 도입하여 인체와 같은 전기적 환경을 만들어준 결과 충분한 치료 효능을 갖춘 고품질 세포를 단시간 내 다량 배양할 수 있게 되었다. 개발한 플랫폼에서 배양한 근육세포를 근육이 손상된 마우스 모델에 이식해 근육 재생 경과를 관찰 한 결과 체내 생존율이 높아져 손상된 근육의 재생 및 손상된 근육 주위 신생혈관 생성량이 기존 외부 근육 세포 배양 기술 대비 4~5배 향상되었다. KIST 유럽 전인동 박사는 “최근 고품질의 체외 세포 생산기술은 점점 좋아지는 반면, 플랫폼 접근 및 사용이 복잡해져 역설적이게도 세포 치료분야의 최종 사용자인 임상의는 이에 접근하기 어려웠다. 개발된 차세대 세포 배양 플랫폼은 최종 사용자의 니즈인 접근성 및 사용 편리성을 최우선적으로 고려했다.”고 밝혔다. KIST 한형섭 박사는 “세포배양 솔루션 공급기업과의 협력을 통해 대량 생산기술 확보 등 실용화 연구로 확장하는 것이 목표”라며, “추후 근육 세포뿐만이 아니라 다양한 세포를 이용한 치료제 연구로 확대 적용이 가능한 기반 기술이 될 것”이라고 밝혔다. 본 연구는 과학기술정보통신부(장관 임혜숙) 지원으로 KIST 주요사업과 한국연구재단 중견연구자지원사업으로 수행되었으며, 이번 연구결과는 기능성 재료 분야 국제 저널인 ‘Bioactive Materials’ (IF: 14.593, JCR 분야 상위 1.25%) 최신 호에 게재되었다. * (논문명) Synergistic stimulation of surface topography and biphasic electric current promotes muscle regeneration - (제 1저자) 한국과학기술연구원 전인동 선임연구원 - (교신저자) 고려대학교 송재준 교수 - (교신저자) 한국과학기술연구원 한형섭 선임연구원? 그림 설명 <span class="se-fs- se-ff- " id="SE-88428522-3128-4b35-91c9-4c19976eedd1" style="margin: 0px; padding: 0px; border: 0px; font-variant-numeric: inherit; font-variant-east-asian: inherit; font-stretch: inherit; font-size: 13px; line-height: inherit; font-family: se-nanumgothic, " \\b098눔고딕",="" nanumgothic,="" sans-serif,="" meiryo;="" vertical-align:="" baseline;="" color:="" rgb(85,="" 85,="" 85);="" text-indent:="" 0px;="" white-space:="" pre-wrap;="" background-color:="" rgb(255,="" 255,="" 255);"="">[그림 1] 근육의 물리적 환경을 모방한 차세대 세포배양 플랫폼에서 획득한 고품질 치료효능을 가진 인체유래 근육전구세포 <span class="se-fs- se-ff- " id="SE-76d28bbd-2a0f-435d-9d60-71240398218c" style="margin: 0px; padding: 0px; border: 0px; font-variant-numeric: inherit; font-variant-east-asian: inherit; font-stretch: inherit; font-size: 13px; line-height: inherit; font-family: se-nanumgothic, " \\b098눔고딕",="" nanumgothic,="" sans-serif,="" meiryo;="" vertical-align:="" baseline;="" color:="" rgb(85,="" 85,="" 85);="" text-indent:="" 0px;="" white-space:="" pre-wrap;="" background-color:="" rgb(255,="" 255,="" 255);"="">[그림 2] 개발한 플랫폼에서 배양한 근육세포를 근육이 손상된 마우스 모델에 이식해 근육 재생 경과를 관찰
- 45
- 작성자생체재료연구센터 한형섭 박사, KIST 유럽 환경안전성연구단 전인동 박사팀
- 작성일2021.12.09
- 조회수8025
-
44
MRI 기반으로 CT 영상 생성하는 인공지능 기술 개발
- 방사선 노출 없이 CT 영상 획득 가능 - MRI만으로 두개골 열지 않는 경두개 집속초음파 시술 가능 경두개 집속 초음파는 두개골을 열지 않고 초음파 에너지를 뇌의 특정 영역에 전달해 퇴행성 운동장애, 난치성 통증 및 정신질환 등을 치료할 수 있는 기술이다. 이 치료술은 뇌 병변의 위치를 파악하는 영상기반의 기술과 함께 사용되어야 하는데, 두개골을 통과한 초음파 초점이 정확히 뇌 병변에 맺히게 하기 위해서는 MRI만으로 파악되기 힘든 환자의 두개골 정보를 CT를 통해 얻어야만 했다. 하지만 방사선 노출이 불가피한 CT는 검사를 자주 해야하는 환자나 소아·임산부 환자의 경우 안전에 대한 우려가 있었다. 한국과학기술연구원(KIST, 원장 윤석진) 바이오닉스연구센터 김형민 박사팀은 MRI 영상을 기반으로 CT 영상을 생성하는 인공지능기술을 개발해 모의치료 실험을 진행한 결과 MRI만으로도 경두개 집속 초음파 시술이 가능하다는 것을 확인했다고 밝혔다. 그간 MRI 영상에서 두개골 정보를 얻으려는 노력이 있었지만, 의료현장에 널리 보급되지 않은 특수한 MRI 코일 장비나 촬영 기술이 필요했다. 또 다른 대안으로 인공지능 기반 CT 영상 획득 기술도 세계적으로 관심이 높았지만 임상적으로 효과가 있다는 것을 증명하지 못했다. 연구진은 초음파를 활용한 모의치료를 통해 인공지능으로 얻은 CT 영상이 임상에 활용이 가능하다는 것을 증명했다. KIST 연구팀은 의료현장에서 가장 많이 활용되는 영상 중 하나인 T1 강조 MRI 영상에서 비선형적으로 CT를 변환하는 과정을 학습하는 3차원 조건부 적대적 생성 신경망 모델(3D conditional adversarial generative network)을 개발했다. CT 영상의 HU (Hounsfield Unit) 픽셀 변화량 오차를 최소화하는 손실함수를 고안하였으며, Z-점수 정규화, 부분 선형 히스토그램 매칭 정규화와 같은 MRI 영상 신호의 정규화 방법에 따른 합성 CT의 품질 변화를 비교하며 신경망 성능을 최적화했다. 안정적이고 효율적인 초음파 치료를 위해서는 반드시 환자의 두개골 밀도비와 두개골 두께를 사전에 파악해야 하는데, 이러한 두개골 인자들을 합성 CT를 통해 파악했을 때 두 인자 모두 실제 CT와 0.90 이상의 상관관계를 보이며 통계적 차이 또한 없는 것을 확인할 수 있었다. 또한, 합성 CT를 이용해 모의 초음파 치료를 시행했을 때, 초음파 초점 간 거리 오차가 1mm 미만, 초음파 음압 오차는 약 3.1%, 초점 부피 유사성은 약 83%인 것을 확인했다. MRI 영상만으로 경두개 집속초음파 치료 시스템을 시술할 수 있다는 가능성을 보여준 것이다. KIST 김형민 박사는 “환자들이 방사선 노출에 대한 걱정없이 집속 초음파 치료를 받을 수 있으며, 추가적인 영상 촬영 및 정렬시키는 과정이 생략되어 의료진의 업무 과정이 간소화됨으로써, 시간적·경제적 비용이 절감될 것으로 예상된다.”며, “초음파 매개변수 및 변환기에 따른 오류율과 다양한 인체 부위에서 인공지능 CT 적용 가능성을 파악하는 후속 연구를 통해 다양한 치료기술에 적용할 수 있도록 발전시켜갈 계획이다”라고 밝혔다. 본 연구는 과학기술정보통신부(장관 임혜숙) 지원으로 국가과학기술연구회 창의형 융합연구사업으로 수행되었으며, 이번 연구 결과는 의료 정보 분야 국제 학술저널인 ‘IEEE Journal of Biomedical and Health informatics(JCR(%): 1.8)’ 최신호에 게재되었다. * (논문명) Acoustic simulation for transcranial focused ultrasound using GAN-based synthetic CT - (제 1저자) 한국과학기술연구원 고희경 학생연구원 - (제 1저자) 한국과학기술연구원 박태영 학생연구원 - (교신저자) 고려대학교 이종환 교수 - (교신저자) 한국과학기술연구원 김형민 책임연구원 그림 설명 [그림 1] 인공지능 합성 CT 기반 집속 초음파 치료술 모식도 [그림 2] MRI에 상응되는 실제 CT(rCT)와 합성 CT(sCT)와 그 오차(|Diff|)를 보여주는 예 [그림 3] 실제 CT(rCT)와 합성 CT(sCT)를 사용한 음향 시뮬레이션 예 합성 CT를 사용해 음향 시뮬레이션을 했을 때 실제 CT를 사용했을 때와 두개골 내 초음파 압력 오차(|Diff|)가 적고 초음파 초점(A90%)의 위치와 부피가 유사한 것을 확인함.
- 43
- 작성자바이오닉스연구센터 김형민 박사팀
- 작성일2021.09.02
- 조회수54298
-
42
원하는 조직만 파괴하는 정밀 집속초음파 수술 기술 개발
- 기포 운동 제어로 기존 집속초음파 기술의 단점인 충격파 산란 효과 극복 - 생체조직 미세하게 제거할 수 있는 비침습 정밀 수술에 적용가능 비침습적 특성을 갖는 다양한 초음파 효과를 이용하여 기존 외과 수술을 대체하려는 시도가 활발하다. 특히 이 가운데 초음파의 초점에서 약 1/100초의 짧은 시간에 생성되는 강력한 기포를(케비테이션) 이용해 주변 생체조직을 칼로 자른 듯 물리적으로 파괴할 수 있는 집속초음파 기반 생체조직 파쇄 기술은 기존의 열로 조직을 태워 없애는 하이푸(HIFU) 방식보다 실시간 케비테이션 분석을 통한 치료과정 모니터가 가능하고 치료시간이 짧다는 장점을 갖고 있다. 한국과학기술연구원(KIST, 원장 윤석진)은 바이오닉스연구센터 박기주 박사가 가변압력 집속초음파를 이용하여 보다 정밀하고 미세하게 생체 조직을 파쇄할 수 있는 새로운 초음파 수술 기술을 개발 했다고 밝혔다. 박 박사는 기존 집속초음파 생체 조직 파쇄 기술에서 초음파 초점 부위뿐만 아니라 그 주변으로 2차 미세 기포들이 동시 다발적으로 발생되는 충격파 산란효과 원리를 학계 최초로 밝혀낸 바있다. 기존 집속초음파 수술 기술은 생체조직을 물리적으로 파쇄할 수 있다는 장점이 있지만, 충격파 산란효과로 인해 정밀도가 낮아져 주요 장기 및 혈관에 밀접하게 위치한 조직 또는 종양을 제거해야 되는 경우에는 적용하기 어려웠다. 이와 같은 한계를 극복하기 위해 초음파 초점에서의 음향 압력세기를 변화시키는 방법을 고안했다. 초음파 초점에서 기포 발생 직후, 순간적으로 초점 음향 압력세기를 변화시키면 충격파 산란 효과 없이 기포의 운동성을 제어하고 이로 인해 생체 조직을 보다 정밀하게 파쇄 할 수 있다고 판단했기 때문이다. 그는 음향 시뮬레이션, 초고속 카메라 기반 인체조직 모사 및 동물 실험을 통해 실현 가능성을 검증했다. 그 결과 초점 음향 압력세기를 조절해 충격파 산란 효과없이 초음파 초점에서 수십에서 수백 마이크론 크기를 갖는 수증기 기포를 생성하고, 기포가 일정 시간 동안 지속 가능하도록 제어하고 조절 할 수 있다는 것을 확인했다. 이는 음향압력 세기가 충격파 산란 효과가 발생하기 시작하는 압력보다 낮기 때문인 것으로, 연구팀은 이를 시뮬레이션을 통해 검증했다. 또한, 초음파 초점에서 기존 집속초음파 기술 대비 훨씬 더 정밀한 수십~수백㎛ 단위로 생체조직을 미세하게 파쇄 할 수 있는 것을 동물실험 단계에서 관찰했다. KIST 박기주 박사는 “이번에 개발한 초음파 기술은 기포의 크기 및 지속 시간을 제어하여 조직의 정밀 파쇄가 가능한 신기술이다. 기존 집속초음파 기술의 최대 단점인 충격파 산란 효과에 의한 낮은 정밀도를 보완했을 뿐만 아니라, 기포 운동 및 지속시간 제어를 통한 파쇄 범위 및 강도 조절이 가능하다. 이를 바탕으로 원하는 특정 세포만을 선택하여 파쇄하거나 탈세포화 기반 세포 이식 연구 분야에도 확대 적용이 가능 할 것으로 예상한다.”라고 말하며, “관련 핵심 초음파 기술은 국내 및 미국에 특허 출원 완료했으며, 정밀 수술 및 시술이 가능한 핸드헬드 타입 초음파 의료기기의 상용화를 목표로 후속 연구를 진행중이다.”고 밝혔다. 본 연구는 과학기술정보통신부(장관 임혜숙) 지원으로 KIST 주요사업 및 한국연구재단 우수신진연구사업의 지원으로 수행되었으며, 연구결과는 음향(Acoustics) 분야 최상위 권위지인 ‘Ultrasonics Sonochemistry’ (JCR 분야 상위 1.562%) 최신호에 게재되었다. * (논문명) Control of the dynamics of a boiling vapour bubble using pressure-modulated high intensity focused ultrasound without the shock scattering effect: A first proof-of-concept study - (단독저자) 한국과학기술연구원 박기주 선임연구원 그림 설명 [그림 1] 새로 개발한 집속초음파 기반 생체조직 파쇄 기술(가변압력 충격파 히스토트립시) 개념도: Pressure-modulated shockwave histotripsy [그림 2] 가변압력 충격파 히스토트립시에 의해서 발생하는 케비테이션 현상을 초고속카메라를 이용하여 인체조직 모사 실험에서 촬영한 결과 [그림 3] 기포에 의해서 산란되는 초음파와 입사되는 초음파와의 상호간섭을 보여주는 음향시뮬레이션 결과. 충격파 산란 효과가 나타나는 압력 역치(-28 MPa) 보다 낮음 [그림 4] 새로 개발한 가변압력 충격파 히스토트립시 기술에 의해 파쇄된 동물의 간 조직 - 1 pulse 적용 후
- 41
- 작성자바이오닉스연구센터 박기주 박사팀
- 작성일2021.08.26
- 조회수41446
-
40
고지혈증 약 스타틴으로 난치성 변이암을 면역 치료한다
- KRAS 변이암을 선택적으로 사멸하고 암에 대한 면역력을 강화 - 신약 재창출을 통해 항암면역 치료제의 높은 의료수가 해결 기대 최근 우리 몸의 면역체계를 활용해 암을 제거하는 방식인 3세대 항암 면역치료가 임상에서 놀라운 효과를 보여 많은 연구진과 환자들에게 희망을 주고 있다. 항암면역치료의 경우 암에 대한 기억 면역이 생겨 정상세포의 손상없이 항암효과가 지속되기 때문에 치료의 경과가 매우 좋고 부작용이 적다는 장점이 있다. 그러나 암의 잦은 변이 등 복잡성으로 인해 평균 30% 미만의 환자에게서만 치료 효과를 보인다는 한계도 있다. 또한 전체 암에서 1/4정도를 차지하는 KRAS 변이암은 항암 면역 치료를 비롯한 여러 치료 방법 개발 시도에도 불구하고 아직까지 치료 옵션이 적어서 암환자의 예후가 매우 나쁜 것으로 알려져 있다. <p class="0" style="text-align: justify; margin-bottom: 13px; border: 0px; outline: 0px; font-variant-numeric: inherit; font-variant-east-asian: inherit; font-stretch: inherit; font-size: 13.3333px; line-height: 1.5; font-family: " 맑은="" 고딕";="" vertical-align:="" baseline;="" min-height:="" 20px;="" background-color:="" rgb(255,="" 255,="" 255);="" text-indent:="" 10pt;"="" align="justify">한국과학기술연구원(KIST, 원장 윤석진) 테라그노시스연구단 김인산 단장과 삼성서울병원 조용범 교수 연구팀은 현재 널리 사용 중인 고지혈증 치료제인 스타틴을 난공불락의 KRAS 변이암 치료에 적용할 수 있는 기전을 밝혔다. <p class="0" style="text-align: justify; margin-bottom: 13px; border: 0px; outline: 0px; font-variant-numeric: inherit; font-variant-east-asian: inherit; font-stretch: inherit; font-size: 13.3333px; line-height: 1.5; font-family: " 맑은="" 고딕";="" vertical-align:="" baseline;="" min-height:="" 20px;="" background-color:="" rgb(255,="" 255,="" 255);="" text-indent:="" 10pt;"="" align="justify">연구진은 종양 동물 모델에 항암제와 스타틴을 정맥주사로 투여했다. 그 결과 스타틴은 KRAS 변이암을 선택적으로 죽이고, 주변 면역세포를 활성화시킬 수 있는 다양한 신호를 방출하게 했다. 이로 인해 체내 면역세포가 암세포에서 신생항원을 효과적으로 포집하고 T세포를 활성화시킴으로써 암을 선택적으로 공격했다. 나아가 스타틴은 기존 항암면역치료에 저항성을 보이는 암 면역환경을 변화시켜 항암 면역치료 효능 또한 보였다. KRAS 변이암의 효과적 치료뿐만 아니라 현재 혈중 콜레스테롤 수치를 낮추기 위해 사용하는 스타틴을 기반으로 한 약물재창출 전략의 가능성을 확인한 것이다. <p class="0" style="text-align: justify; margin-bottom: 13px; border: 0px; outline: 0px; font-variant-numeric: inherit; font-variant-east-asian: inherit; font-stretch: inherit; font-size: 13.3333px; line-height: 1.5; font-family: " 맑은="" 고딕";="" vertical-align:="" baseline;="" min-height:="" 20px;="" background-color:="" rgb(255,="" 255,="" 255);="" text-indent:="" 10pt;"="" align="justify">스타틴이 성공적인 약물재창출 사례가 되기 위해서는 향후 추가적인 임상 연구를 통해 최적의 용법을 찾아야 하며, 암 조직에 좀 더 효과적으로 스타틴을 전달할 수 있는 방법도 연구되어야 한다. 이러한 과정을 거쳐 실제 임상이 성공할 경우 신약개발 시간 및 비용을 획기적으로 절감할 수 있을 것이며, 더 나아가 항암 면역치료제의 높은 의료 수가가 큰 사회적 문제인 상황에서 이를 해결하는 단초가 될 것으로 기대된다. <p class="0" style="text-align: justify; margin-bottom: 13px; border: 0px; outline: 0px; font-variant-numeric: inherit; font-variant-east-asian: inherit; font-stretch: inherit; font-size: 13.3333px; line-height: 1.5; font-family: " 맑은="" 고딕";="" vertical-align:="" baseline;="" min-height:="" 20px;="" background-color:="" rgb(255,="" 255,="" 255);="" text-indent:="" 10pt;"="" align="justify">KIST 김인산 단장은 “임상에서 이미 사용되고 있는 스타틴이 인체의 면역시스템을 활성화시켜 KRAS 변이암을 적으로 인식, 기억하게 함으로써 암세포의 면역원성 사멸을 유도할 수 있었다. 이는 기존 항암 면역치료제의 한계를 극복한 것으로, 향후 스타틴이 차세대 항암 면역치료제로 활용 가능할 것으로 기대한다.”라고 밝혔다. <div class="hwp_editor_board_content" style="text-align: justify; margin: 0px; padding: 0px; border: 0px; outline: 0px; font-variant-numeric: inherit; font-variant-east-asian: inherit; font-stretch: inherit; font-size: 13.3333px; line-height: inherit; font-family: " 맑은="" 고딕";="" vertical-align:="" baseline;="" background-color:="" rgb(255,="" 255,="" 255);"="" align="justify"> <p class="0" style="text-align: justify; margin-bottom: 13px; border: 0px; outline: 0px; font-variant-numeric: inherit; font-variant-east-asian: inherit; font-stretch: inherit; font-size: 13.3333px; line-height: 1.5; font-family: " 맑은="" 고딕";="" vertical-align:="" baseline;="" min-height:="" 20px;="" background-color:="" rgb(255,="" 255,="" 255);="" text-indent:="" 10pt;"="" align="justify">본 연구는 과학기술정보통신부(장관 임혜숙) 리더연구자 지원사업, 신진연구자 지원사업, KIST 주요사업, 그리고 보건복지부(장관 권덕철) 보건의료인재양성지원사업으로 수행되었으며 연구결과는 국제 학술지인 ‘Journal for immunotherapy of cancer’(IF : 13.751)에 최신호에 게재되었다. <p class="0" style="text-align: justify; margin-bottom: 13px; border: 0px; outline: 0px; font-variant-numeric: inherit; font-variant-east-asian: inherit; font-weight: bold; font-stretch: inherit; font-size: 13pt; line-height: 1.5; font-family: " 맑은="" 고딕";="" vertical-align:="" baseline;="" min-height:="" 20px;="" background-color:="" rgb(255,="" 255,="" 255);="" text-indent:="" 10pt;"="" align="justify"> <p class="0" style="text-align: justify; margin-bottom: 13px; border: 0px; outline: 0px; font-variant-numeric: inherit; font-variant-east-asian: inherit; font-stretch: inherit; font-size: 13.3333px; line-height: 1.5; font-family: " 맑은="" 고딕";="" vertical-align:="" baseline;="" min-height:="" 20px;="" background-color:="" rgb(255,="" 255,="" 255);="" text-indent:="" 10pt;"="" align="justify">* (논문명) Statin-mediated inhibition of RAS prenylation activates ER stress to enhance the immunogenicity of KRAS mutant cancer <p class="0" style="text-align: justify; margin-bottom: 13px; border: 0px; outline: 0px; font-variant-numeric: inherit; font-variant-east-asian: inherit; font-stretch: inherit; font-size: 13.3333px; line-height: 1.5; font-family: " 맑은="" 고딕";="" vertical-align:="" baseline;="" min-height:="" 20px;="" background-color:="" rgb(255,="" 255,="" 255);="" text-indent:="" 10pt;"="" align="justify">- (제 1저자) 한국과학기술연구원 남기훈 위촉연구원 <p class="0" style="text-align: justify; margin-bottom: 13px; border: 0px; outline: 0px; font-variant-numeric: inherit; font-variant-east-asian: inherit; font-stretch: inherit; font-size: 13.3333px; line-height: 1.5; font-family: " 맑은="" 고딕";="" vertical-align:="" baseline;="" min-height:="" 20px;="" background-color:="" rgb(255,="" 255,="" 255);="" text-indent:="" 10pt;"="" align="justify">- (제 1저자) 고려대학교 안암병원 권민수 교수 <p class="0" style="text-align: justify; margin-bottom: 13px; border: 0px; outline: 0px; font-variant-numeric: inherit; font-variant-east-asian: inherit; font-stretch: inherit; font-size: 13.3333px; line-height: 1.5; font-family: " 맑은="" 고딕";="" vertical-align:="" baseline;="" min-height:="" 20px;="" background-color:="" rgb(255,="" 255,="" 255);="" text-indent:="" 10pt;"="" align="justify">- (교신저자) 삼성서울병원 조용범 교수 <p class="0" style="text-align: justify; margin-bottom: 13px; border: 0px; outline: 0px; font-variant-numeric: inherit; font-variant-east-asian: inherit; font-stretch: inherit; font-size: 13.3333px; line-height: 1.5; font-family: " 맑은="" 고딕";="" vertical-align:="" baseline;="" min-height:="" 20px;="" background-color:="" rgb(255,="" 255,="" 255);="" text-indent:="" 10pt;"="" align="justify">- (교신저자) 한국과학기술연구원 김인산 책임연구원 그림 설명 [그림 1] 스타틴의 항암 면역 치료 모식도 스타틴이 KRAS 변이암에서 KRAS 신호를 억제하여 면역원성 세포 사멸을 유도하고 주변 면역세포를 활성화하여 면역세포가 다시 KRAS 변이암을 지속적으로 공격할 수 있음을 나타낸 모식도이다. [그림 2] 스타틴과 기존 항암제인 (Oxaliplatin)의 병합 치료가 암 면역 환경을 활성화하여 기존 항암 면역 치료제의 효능을 높일 수 있음을 보여주는 결과. (A) 스타틴과 기존 항암제 (옥살리플라틴) (Sta+Oxa) 병합 치료가 대조군에 비해 (Control) 암 조직 내로 CD8 T cell (세포 독성 T 세포)의 침투를 촉진하고 암 면역 환경을 변경함을 보여줌. (B, C) 스타틴과 기존 항암제의 병합 치료가 항암 면역 치료제인 PD-1 항체의 항암 효능을 높이고 암 생존율을 향상함을 보여줌.
- 39
- 작성자테라그노시스연구센터 김인산 박사팀
- 작성일2021.08.24
- 조회수41064

![[그림 1] (좌) MOF가 도입된 반도체 기반 바이오센서의 구조 (우) 바이오센서를 활용하여 신경전달물질을 전기적 신호 패턴을 통해 구분한 결과. 구조가 매우 비슷한 다종의 신경전달물질은 MOF에 선택적으로 흡착되며, 이에 따라 다른 전기신호 패턴을 나타냄. 패턴 분석을 통해 각 신경전달물질을 구분하고 정량적으로 검출함.](/app/board/attach/image/thumb_11104_1676523497000.do)