연구본부소개
-
8
몸에서 녹는 금속 나사의 뼈 생성 원리 밝혀
몸에서 녹는 금속 나사의 뼈 생성 원리 밝혀 - 생체 분해성 금속 소재의 인체 내 분해 메카니즘 규명 - 산학연병 공동연구 결과로 국내 의공학 연구의 새로운 모델 제시 빙판길 낙상사고가 급증하는 계절, 낙상을 포함하여 사고로 인해 골절 환자가 증가하고 있다. 골절 부상은 보통 부러진 뼈를 고정하는 장치를 사용하여 수술하게 되는데, 몸속에 남아있는 금속 임플란트로 인해 우리는 부작용을 겪거나 불편함을 경험하게 된다. 국내 산학연병 공동연구진이 이러한 문제를 해결할 수 있는 생분해성 금속 정형외과 임플란트를 개발하였다. 생분해성 금속은 체내 이식 후 일정 기간(1-2년)이 경과되면 분해되어 체내에서 소멸되는 소재로서, 이러한 소재를 이용하여 의료기기를 제조하면 손상된 인체조직이 복원된 후 이식된 의료기기를 제거하는 2차 시술을 생략할 수 있다. 한국과학기술연구원(KIST, 원장 이병권) 의공학연구소 생체재료연구단 김유찬 박사팀은 인체 구성원소를 이용하여 제조된 생분해성 금속이 실제로 환자에게 장기간 이식 되어도 아무런 문제가 없다는 것을 최첨단 분석기법을 이용하여 과학적으로 증명하였다. 연구팀은 향후 이 소재를 이용한 다양한 혁신 의료용 임플란트가 개발될 수 있는 결과를 발표하였다. 특히 이 생분해성 금속은 골절치료 분야에 새로운 장을 열 것으로 기대된다. 본 연구는 생분해성 마그네슘 합금이 체내에서 녹는 과정을 보여주는 세계 최초의 연구결과이다. 연구진은 기존의 염색기법과는 다른 빌라누에바(villanueva) 골염색법이라는 새로운 분석기법과 재료연구에 사용되는 전자현미경을 이용하여 쉽게 관찰할 수 없었던 생체분해성 금속과 인체조직간 계면에서 일어나는 연속적 분해거동을 세포에서 원자단위까지 계층적인 분석을 통해 밝혀내었다. 특히, 골 염색으로 관찰한 생물학적 영역에서의 분석에 그쳤던 기존의 연구결과와는 달리, 생분해성 금속소재영역과 그 경계까지의 연속적인 변화거동을 재료분석 기법인 전자현미경을 사용하여 동시에 관찰했다. 생분해성 금속이 체내에서 녹으면서 신생골을 형성시켜 골절의 치료에 도움을 주는 현상을 시간의 흐름에 따라 확인할 수 있었다. 연구진이 개발한 마그네슘 임플란트는 아주대학교 병원에서 53개의 사례에 이식되어 각각 6개월에서 12개월간 관찰하여 어떠한 부작용도 없이 치료를 완료하였으며, 이를 통해 판매허가를 획득한 바 있다. 본 연구에서는 이 과정에서 생분해성 마그네슘이 녹으면서 주변골과 유사한 조직을 만들고 이들 주변에 뼈조직을 형성하는 세포를 불러들여 최종적으로 신생골로 변화시키는 과정을 확인했다. 이 같은 결과는 장기간 임상결과를 통해, 치료효과에 대한 과학적인 근거를 바탕으로 인체에 대한 안정성 및 기능성을 동시에 증명한 결과로서 이후 생분해성 금속소재의 사용에 대한 인식을 전환시켜 많은 영역에 활용될 수 있는 가능성을 제시하고 있다. 김유찬 박사는 “본 기술은 KIST, U&i(주), 서울아산병원, 아주대병원, 국민대학교 등 산학 연병의 컨소시엄으로 구성하여 기초연구에서부터 임상결과까지 전 과정을 고찰하여 얻어진 융합연구로서, 의공학 연구에 새로운 모델을 제시한 의미 있는 결과이다. 하지만, 재료물성의 한계로 수지부와 같은 비교적 응력을 덜 받는 부위에만 사용하고 있고, 향후 강도 및 연신율이 향상된 마그네슘 함금개발이 반드시 진행되어야 한다. 이에 본 연구결과를 바탕으로 골 전반에 걸쳐 사용할 수 있는 새로운 합금이 개발된다면 연 30~40조원에 해당하는 시장이 창출될 것으로 예상되며 이와 같은 시장을 선점하기 위해서는 국가적 지원이 절실히 필요하다”고 밝혔다. 본 연구는 KIST 의공학연구소 플래그쉽 연구사업과 서울시 RNBD사업의 지원으로 수행되었으며, 연구결과는 세계적 학술지인 미국국립과학원회보(Proceedings of the National Academy of Sciences; PNAS) 1월 4일자 온라인판에 게재되었다. * (논문명) Long-term clinical study and multiscale analysis of in vivo biodegradation mechanism of Mg alloy - (공동 제1저자) 국민대학교 이지욱 연구교수, 한국과학기술연구원 한형섭 연구원, 아주대학교병원 한경진 교수 - (공동 교신저자) 한국과학기술연구원 김유찬 책임연구원, 서울아산병원 이강식 박사 <그림자료> <그림 1> 본 연구에서 계층적 분석을 한 조직학적 사진 및 전자현미경사진. 토끼 대퇴골과에 마그네슘 합금 임플란트를 식립하고 8주 후가 되면 최초 임플란트가 체내에서 녹으면서 석회화층과 신생골이 생성되고 있는 것을 관찰 할 수 있다. <그림2> 마그네슘 합금 임플란트과 신생골 계면에 대한 전자현미경 분석. (A) 마그네슘과 산소가 많은 영역I, 칼슘과 인이 많은 영역II, III, V, 탄소가 많은 영역IV로 구분된다. (B) 각 영역에 대한 미세구조의 변화를 보여주는 사진으로, 영역 I, 영역 II는 비정질구조, 영역 II’, 영역 III은 결정질 구조를 나타낸다. (C) 각 영역에 대한 (마그네슘+칼슘) / 인의 비율, 마그네슘 (%), 칼슘 (%), 인 (%)의 성분변화. <그림3> 식립 기간에 따른 마그네슘 합금 임플란트 계면의 villanueva 염색된 골조직사진이며 (A)는 8주 (B)는 16주 그리고 (C)는 26주를 나타낸다. (A, i) 식립 후 8주에서 마그네슘합금의 녹는 모습을 형광 저배율에서 찍은 사진이며 , (B, i) 식립 후 16주, (C, i)는 26주 후의 저배율 사진이다. (A, ii) 식립 후 8주에서 뼈의 형성 모습을 형광-고배율에서 찍은 사진이며, (B, ii) 식립 후 16주, (C, ii)는 26주 후의 고배배율 사진이다. 그리고 (A, iii) 식립 후 8주에서 뼈의 형성 모습을 자영광-고배율에서 찍은 사진이며, (B, iii) 식립 후 16주, (C, iii)는 26주 후의 고배배율 사진이다. (A, i), (B, i), (C, i)의 주황색 실선은 원래의 임플란트 표면을 나타내며, 파란색의 점선은 각 식립시간에서의 임플란트 중앙부를 나타낸다. <그림4> 마그네슘 이식 1년 후, 완전히 녹으면서 뼈가 치유된 임상결과이다. (A) 요골 골절에 이식한 마그네슘합금 임플란트(MI)와 주상골 골절 부위에 스테인레스 임플란트(SI)를 이식 후, 1년 후 환자의 왼쪽 X-ray 사진이다. (B) 시술 경과에 따른 X-ray 사진을 나타낸다. (i) 시술 전 요골 골절과 주상골 골절 (ii) 시술 직후 요골 골절에 식립한 MI (노란색 화살표)와 주상골 골절부에 이식된 SI, (iii) 시술 6개월 후 요골 골절에 이식된 MI와 주상골 골절부에 식립한 SI, (iv) 시술 12개월 후 경과. (C) 시술 경과에 따른 MI의 변화를 설명하는 모식도. 빨간색 화살표는 요골 골절, 백색 화살표는 주상골 골절, 노란색 화살표는 MI를 나타낸다.
- 7
- 작성자생체재료연구단 김유찬 박사팀
- 작성일2016.01.14
- 조회수28294
-
6
조직재생을 촉진하는 신개념 금속임플란트 개발
조직재생을 촉진하는 신개념 금속임플란트 개발 - 배터리 기술을 응용하여 금속이 혈관 생성을 촉진 - 기존 의료용 금속소재에 쉽게 적용할 수 있어 상용화 가능성 높아 의료용 금속소재는 강도가 우수하고 쉽게 깨지지 않는 고유의 성질을 바탕으로 정형외과, 치과, 심혈관계 등 강도와 안정성이 요구되는 전 분야에 걸쳐 인체 내 이식소재로 사용되고 있으나, 체내에서 생화학적인 활성을 기대하기는 어려웠다. 이를 극복하기 위한 방법으로 생화학적인 활성을 부여할 수 있는 세라믹이나 고분자 코팅 등을 많이 사용하지만 금속과의 결합력이 약하여 의료기기의 내구성과 신뢰성을 저하시킬 수 있는 등 제약이 많다. 한국과학기술연구원(KIST, 원장 이병권) 의공학 연구소 생체재료연구단 옥명렬 박사 연구팀은 기존의 의료용 금속 소재에 간단한 처리만으로 혈관 형성을 유도하여 조직 재생을 촉진하는 기능을 가지는 신개념 금속 기능화 기반기술을 개발했다. 티타늄이나 코발트-크롬 합금과 같은 의료용 금속 소재는 일반적으로 체내에서의 부식을 막아주는 나노미터 두께의 자연 산화막이나 의도적으로 형성시킨 더 두꺼운 산화막으로 덮여있다. 연구팀은 이들 금속의 산화막이 광촉매반응 또는 전기화학적 촉매반응을 통해 적절한 저농도에서 혈관 생성을 촉진한다고 알려져 있는 활성산소를 만들어낼 수 있음에 착안하여 본 기술을 개발하였다. 체내에는 이들 산화막을 촉매로 사용하는 데에 필요한 광원(光源) 또는 전원(電源)이 없다는 문제가 있다. 연구팀은 KIST 생체재료연구단의 대표 발명품인 몸에서 녹는 금속의 주성분인 마그네슘을 활용하여 이 문제를 해결했다. 즉, 의료용 금속소재와 마그네슘을 접촉시켜 배터리와 같은 구조를 만들면 마그네슘의 부식반응으로 생성된 전자가 도체인 의료용 금속 소재의 표면으로 확산되고 산화막 표면에서 산소를 환원시켜 활성산소를 만들어 낼 수 있다는 것이다. 연구팀은 산화막의 두께, 마그네슘과 의료용 금속 소재의 표면적 비율과 같은 재료과학적인 인자를 조절하여 활성산소의 생성 속도를 제어했다. 활성산소의 농도를 조절시켜 가면서 활성산소의 독성은 나타나지 않으면서도 혈관내벽세포는 활성화시키는 최적의 농도를 찾았다. 이를 통해 혈관 생성 촉진을 통한 조직 재생 유도형 의료용 금속의 개발이 가능하다는 것을 세포실험을 통해 확인하였다. 특히, 가능성의 검증에서 멈추지 않고 개발 기술의 상용화를 목표로 정형외과 및 치과에서 많이 사용하는 나사 형태의 시작품을 개발하였다. 이렇게 만들어진 시작품에서도 충분한 농도의 활성산소가 발생하고 그에 따른 혈관형성 촉진 효과를 세포실험을 통해 확인하였다. 개발된 기술의 장점은 오로지 금속과 그 산화막만으로 이루어진 기술이므로 금속 의료기기의 강도를 손상시키지 않고 코팅층의 박리와 같은 신뢰성 관련 문제가 발생하지 않는다는 점이다. 또한 새로운 재료의 개발 없이 기존에 널리 사용되는 의료용 금속소재간의 간단한 조합을 통해 개발한 기술인만큼 제품 인허가에 소요되는 시간을 단축하여 실용화 할 수 있으며 기존 시장 전체를 공략 대상으로 할 수 있다는 장점이 있다. 옥명렬 박사는 “본 기술은 KIST의 금속공학, 촉매화학, 전기화학, 조직공학, 나노공학 등 다양한 분야의 전문가들이 협력하여 개발한 융합기술로 특히 고대병원과의 협력을 통해 상용화를 위한 개발 방향 설정이 가능하였다. 간단한 추가 공정을 통해 기존의 거의 모든 금속 의료기기에 직간접적으로 적용될 수 있어 상용화 되면 경제적 파급효과가 클 것이다.”고 밝혔다. 본 연구는 KIST 의공학연구소 미래원천 연구사업과 플래그쉽 연구사업의 지원으로 수행되었으며, 연구결과는 독일에서 발행되는 화학 분야의 세계적 학술지인 앙게반테 케미 국제판(Angewandte Chemie International Edition) 10월 20일자 온라인판에 게재되었다. * (논문명) Magnesium corrosion triggered spontaneous generation of H2O2 on oxidized titanium for promoting angiogenesis - (제1저자) 한국과학기술연구원 박지민 연구원 - (교신저자) 한국과학기술연구원 옥명렬 선임연구원 <그림자료> <그림 1> 일차전지 반응을 이용한 활성산소 생성에 대한 개념도. 광원이나 전기 에너지와 같은 외부 자극 없이 오로지 마그네슘의 부식을 통해서 자발적으로 전자와 활성산소를 발생시키는 원리에 대한 설명 (좌). 마그네슘의 산화과정을 통해 만들어진 전자가 티타늄 쪽으로 이동하여, 티타늄 주변의 산소를 환원시켜 과산화수소를 만들게된다 (우) <그림2> 개발된 조직재생용 임플란트 내 활성산소 생성의 전기화학적 평가. 티타늄 주변에서 자발적으로 과산화수소가 발생하는 것을 다양한 전기화학 방법을 통하여서 확인하였음. 특히나 질소가 포화된 용액과 산소가 포화된 용액에서의 특성을 비교함으로써, 활성산소 생성을 확인할 수 있었음. <그림3> 개발된 조직재생용 임플란트에서 발생되는 과산화수소의 농도를 혈관내피세포 배지와 생체유사용액에서 측정. (위) 측정된 농도 데이터를 기반으로, 혈관 내피세포에 임플란트를 30분 동안 도입한 결과, 성장인자가 없음에도 불구하고 현저하게 많은 혈관 네트워크가 생성됨을 확인함. 실제로, 임플란트를 도입하지 않고, 성장인자가 없는 경우 (negative control) 거의 혈관 네트워크가 생성되지 않는 것을 확인할 수 있음. 이는 본 임플란트 기술이 성장인자 없이도 혈관생성을 유도할 수 있다는 것을 나타냄. (아래) <그림4> 앞서 이용한 마그네슘과 티타늄을 하나의 형태로 결합한 “일체형” 임플란트 모형. 앞선 결과와 유사하게, 일체형 임플란트에서도 성장인자 없이 혈관 네트워크가 생성되는 것을 확인함. <그림5> 전체 연구 결과의 모식도. 일차 화학전지 기술을 이용하여, 자발적으로 활성산소가 만들어진 마그네슘-티타늄 기반 금속 임플란트를 개발함. 자발적으로 발생된 활성산소는 조직재생에서 중요한 과정 중에 하나인, 혈관신생능력을 향상시키는 것으로 확인됨.
- 5
- 작성자생체재료연구단 옥명렬 박사, 박지민 연구원 연구팀
- 작성일2015.10.28
- 조회수27752
-
4
독성없이 쉽게 유전자로 암치료하는 siRNA 전달체 개발
독성없이 쉽게 유전자로 암치료하는 siRNA 전달체 개발 - RNA 폴리머 압축기술 개발로 전신주입 안정성 및 생체독성 부작용 해결 - 암세포내에서 siRNA로 전환할 수 있는 지능성 약물전달체 제조해 암유전자 억제효율 최대화 세포가 외부 단백질을 억제해 스스로를 보호하는 작용인 ‘세포 청소’는 생명을 유지시키는데 필수적이다. 세포의 자정능력으로도 알려져있는 세포 청소에는 micro RNA, siRNA(small interfering RNA)와 같은 청소부들이 유전자의 발현을 억제시켜 불필요한 단백질을 없앤다. 국내 연구진이 이러한 siRNA를 활용해 약물을 전달하는 동시에 암세포를 청소할 수 있는 신개념 RNA를 만들었다. 기존 RNA 약물에 쓰였던 독성물질을 사용하지 않아 독성 문제가 없고, 혈관에서 안정적이라 정맥주사로 치료제 투여가 가능해, 힘들고 부작용이 컸던 항암 치료에 활용될 경우 효과가 높을 것으로 보인다. 유전자를 활용한 암치료에 새로운 패러다임을 제시하였다. 한국과학기술연구원(KIST, 원장 이병권)은 의공학 연구소 안형준 박사 연구팀은 “RNA 중합효소로 합성된 RNA 폴리머를 기반으로 하는 신개념의 siRNA 전달체를 제조하고 이를 암 유전자 치료에 활용하는 기술을 개발했다”고 밝혔다. 세포가 스스로 자정작용을 하는 RNAi(RNA interference) 현상을 이용한 유전자 조절기술은 생체 대사 조절에 필요한 단백질 생산을 효과적으로 줄일 수 있는 장점이 있다. 그러나 단백질을 생산하는 표적세포까지 siRNA를 전달하는 기술 개발이 부진해 암과 같은 난치성 질환에 응용하기 어려웠다. 또한, 기존 siRNA 약물은 세포수준에서 유전자 발현을 억제해 암 세포의 증식을 막는 효과는 크지만 독성이 높은 합성물질을 사용해 동물모델에서 면역 시스템의 문제를 일으키고 암에만 선택적으로 작용되지 않는 단점이 있었다. 연구진은 혈액내의 핵산분해효소에 영향을 받지 않고 정맥주사로 쉽게 siRNA를 안정적으로 전달하기 위해 물과 섞이지 않는 소수성 콜레스테롤 분자를 이용한 RNA 폴리머 압축기술을 개발했다. 또한 건강한 조직은 건드리지 않고, 암조직으로만 약물 전달이 가능한 특정분자 코팅법을 고안하여 RNA 전달체를 제조하였다. 연구진은 DNA-콜레스테롤 및 DNA-폴레이트와의 순차적인 염기쌍을 형성한 물질을 siRNA 표면에 표시하여 siRNA를 제조하였다. 이렇게 만들어진 신개념 siRNA 전달체는 잠재적 면역독성 문제를 지니는 합성양이온을 사용하지않아 면역독성으로부터 자유롭고 혈액내에 핵산분해효소들의 공격으로부터 안정한 특징을 가지게 된다. 뿐만 아니라, 그 자체가 암 선택적 항암약물 전달체이면서 동시에 항암약물이 작동하는 전단계로서의 물질로서의 항암치료효과를 나타내게 되는 이중적 기능을 가진 siRNA가 된다. 신개념 RNA 압축기술은 RNA 밀도를 10배 이상 높여 실질적으로 생체적용이 가능한 나노사이즈 크기의 나노파티클 제조가 가능하였으며 동시에 고밀도의 siRNA 서열 탑재가 가능하였다. 본 연구팀이 개발한 RNA 폴리머 기반 약물전달체는 암세포에 도달하기 전까지는 전달체 기능을 수행하다가 암세포에 도착한 후에는 세포내의 특정 효소작용을 이용해 siRNA 약물로 전환된다. 개발한 약물은 화학적 합성법이 아니라 RNA 중합효소로 합성된다는 점에서 기존 약물 보다 수백 배 이상의 저렴한 비용으로 생산이 가능하고 이는 향후 유전자 치료제로서의 적용가능성을 높일 것으로 예상된다. 본 연구를 수행한 KIST 테라그노시스 연구단의 안형준 박사(교신저자)와 장미희 박사(제1저자)는 “개발한 기술은 생체내 약물을 전신주입 했을 때 발생하는 기존 문제점들을 해결하여 유전자 치료제의 효과가 암세포에서 집중적으로 나타나기 때문에 효과적이다”며 “암의 성장, 전이 및 약물 내성과 관련해 유전자를 활용한 치료제 개발 가능성을 높여 주었다.”고 연구의 의의를 밝혔다. 본 연구는 미래창조과학부 GiRC 시범사업, 보건복지부 암정복추진연구개발사업 및 KIST 미래원천 의공학기술개발사업의 지원으로 수행되었으며, 연구결과는 Nature Communications에 8월 6일(목)일자 온라인판에 게재되었다. * (논문명) Design of a platform technology for systemic delivery of siRNA to tumours using rolling circle transcription - (제1저자) 한국과학기술연구원 장미희 박사 - (교신저자) 한국과학기술연구원 안형준 박사 <그림자료> <그림 1> RNA 중합효소를 이용한 RNA 폴리머 합성, 소수성 분자 및 특정표적 분자의 순차적 염기쌍 형성을 통한 나노파티클 제조 개념도. 신개념의 양친매성 RNA 폴리머를 디자인하여 수용액상에서의 자가조립현상이 가능하도록 하였고 궁극적으로 마이크로미터 크기의 RNA 폴리머를 나노미터 크기로 압축하여 세포투과, 생체 정맥주입, 암조직으로의 선택적 전달이 가능하도록 하였다. <그림2> 동물암모델에서의 정맥 주입을 통해 siRNA 전달체가 암조직에 선택적으로 전달됨을 보여주는 형광 이미지. 실시간 형광 이미지(a)와 48시간 이후에 적출된 장기조직에서의 형광 이미지(c)는 siRNA 전달체가 효과적으로 암조직에 선택적으로 축적됨을 보여준다. <그림3> 특정 형광단백질이 표현되는 동물암모델에서 siRNA 전달체가 특정 형광단백질 유전자의 발현을 억제한다는 것을 보여주는 형광영상 이미지. 정맥주입한 후 암조직에서의 특정 형광단백질이 발현되는 것이 효과적으로 억제됨을 형광 영상이 나타내고 있으며, 그렇지 않은 동물의 암조직에서는 특정 형광단백질의 발현이 증가되고 있음을 나타내고 있다.
- 3
- 작성자의공학연구소 안형준 박사팀
- 작성일2015.08.20
- 조회수28589
-
2
나노구멍으로 세포 조절, 기능성 강화된 생체재료 제작
나노구멍으로 세포 조절, 기능성 강화된 생체재료 제작 - KIST, 레이저공정을 이용한 나노표면으로 세포의 부착, 이동방향 조절 - 생체재료 표면에서의 세포 반응 규명, 차세대 기능성 인체이식 의료기기 개발에 적용 생체이식 소재연구는 몸속에서 안전하고, 생체에 안정적으로 이식이 가능해야하며, 주변 조직에 기능적으로 어떤 영향을 미치는 지가 중요한 이슈이다. 국제 연구진이 특수 레이저를 이용하여 생체이식 소재의 표면을 조절해 기능성을 강화할 수 있는 세포 조절 나노패터닝 기술을 개발했다. 기능성 생체재료는 인체에서 분해되는 금속이나 고분자, 약물 전달을 위한 고분자 코팅 등에 한정되어 사용할 수 있는 소재가 제한적이다. 생체 이식용으로 가장 많이 활용되고 있는 타이타늄과 같은 소재는 우수한 기계적 강도를 갖고 있지만, 인체 조직의 활성과는 관련이 없는 소재이다. 연구진이 개발한 레이저 패터닝 기술을 활용하면 다양한 생체재료 소재의 표면을 기능화하여, 인체에 활성을 가지지 않는 소재들도 생체기능성 소재로서 활용할 수 있을 것으로 기대된다. 개발기술을 활용하면 생체재료의 부작용을 최소화하는 인공수정체와 혈관스텐트, 부러진 뼈를 고정할 뿐 아니라 뼈재생까지 촉진하는 임플란트 등의 개발이 한층 앞당겨질 전망이다. 한국과학기술연구원(KIST, 원장 이병권) 의공학연구소 생체재료연구단 전호정 박사는 미국 버클리 캘리포니아 주립대(UC Berkeley) 기계공학과 코스타스 그리고로폴러스(Costas Grigoropoulos) 교수와 재료공학과 케빈 힐리(Kevin Healy) 교수팀과의 공동연구를 통해 펨토초 레이저를 이용하여 만든 1마이크로미터(백만분의 1미터) 미만의 나노구멍 패턴을 이용하여 재료 표면에서의 세포 성장과 운동을 조절하는 메커니즘을 규명하는데 성공했다고 밝혔다. 우리 몸을 구성하는 기본 단위인 세포는 혈액 속에 떠다니는 혈관 세포를 제외하고는 대부분 이웃하고 있는 세포나 세포주변을 감싸고 있는 조직의 표면에 부착하여 생존하거나 기능을 발현하게 된다. 임플란트와 같은 생체재료를 이식했을때도 마찬가지로 세포가 와서 붙게 된다. 이때 세포는 사람의 발과 비슷한 역할을 하는 초점 접착역(Focal Adhesion)의 형태를 통해 생체재료 표면에 부착되고 이를 통하여 외부의 물리, 화학적 신호를 받아들인다. 연구진은 생체 재료 표면에 나노구멍을 만들고 그 크기와 간격을 바꾸어 실험한 결과 나노구멍이 세포의 초점접착역에 영향을 미칠 수 있다는 점을 발견했다. 연구진은 단일 레이저 펄스의 폭이 100 펨토초(10-15초)인 레이저를 이용하여 직경이 500에서 1000 나노미터이면서 깊이가 500 나노미터인 나노구멍으로 이루어진 표면을 제작하였다. 나노구멍 간격을 조정하면 세포가 붙지 않는 표면을 만들거나, 세포를 특정한 장소로 몰아서 세포들이 띠모양, 원모양 등으로 그룹을 형성하도록 유도할 수 있다. 이러한 재료표면 제어를 통해 임플란트 표면에 세포가 붙지 않게 하거나 선택적으로 세포를 붙게 할 수 있다. 또한 패턴으로 인한 물리적 자극으로 임플란트 주변조직의 재생을 억제하거나 촉진시킬 수가 있다. 세포는 살아있는 생명체로서 주변 환경에 반응하여 스스로 살기에 더 적합한 환경 혹은 자신의 역할이 필요한 곳으로 이동하는 경향을 보인다. 세포는 일반적으로 초점접착역의 부착에 관여하는 단백질의 농도가 높고, 부착한 표면이 더 단단한 곳으로 이동한다고 알려져 있다. 연구진이 개발한 방법은 기존에 알려져 있는 세포 이동 조절인자 외에 레이저로 나노구멍을 만들어 세포의 이동 방향을 조절하는 기술로, 기존 기술과 달리 실제 인체에 삽입하는 임플란트 표면에 적용하기가 용이하여 기능성 임플란트의 상용화에 쉽게 적용될 수 있다. 또한, 연구진이 개발한 나노구멍 패터닝 기술은 펄스폭이 아주 작은 특수한 펨토초 레이저를 사용하기 때문에 고분자, 세라믹, 금속 표면에 모두 적용이 가능하며, 유해한 화학물질 사용없이 나노구멍의 크기를 조절해 인체에서 안정적이라는 장점이 있다. 인공수정체나 혈관스텐트와 같이 세포의 과다 증식으로 후속 질환이 발생하는 소재에 적용하여 세포 증식을 억제하는 기능성 생체재료를 만들 수 있고, 뼈 고정용 임플란트 표면에 활용하여 뼈 재생을 촉진시킬 수 있는 기능화된 의료기기 제작도 가능하다. 공동 제 1저자인 KIST 전호정 박사는 “개발한 기술로 다양한 차세대 기능성 인체이식 의료기기 개발이 가능할 것으로 보인다”며, “세포의 부착 특성은 세포의 분화 및 증식과도 연관이 높기 때문에 후속연구를 통해 줄기세포의 분화능력은 유지한 채, 세포의 양을 늘리는 배양 기술이 필요한 줄기세포 치료제 등의 생산에도 활용이 가능하다.”고 밝혔다. 본 연구는 미국 NIH(National Institute of Health, 국립보건원) 지원으로 수행되었으며, 연구결과는 네이처 머티어리얼즈 (Nature Materials)에 7월 27(월)일자 온라인판에 게재되었다. *(논문명) Directing cell migration and organization via nanocrater-patterned cell-repellent interfaces - (공동 제1저자) (한국과학기술연구원) 전호정 박사, (UC Berkeley) 구상모 박사과정 - (공동 교신저자) (UC Berkeley) Costas Grigoropoulos 교수, (UC Berkeley) Kevin Healy 교수 <그림자료> <그림1> 펨토초 레이저 공정을 이용하여 만든 나노구멍. (a) 렌즈 선택에 따른 다양한 종횡비를 가지는 나노구멍을 보여주며, (b) 나노구멍 패턴을 보여주는 SEM 이미지 및 (c, d) 레이저의 펄스 에너지에 따른 나노구멍 크기를 보여준다. <그림 2> (a) 간격 구배를 갖는 나노구멍 패턴 디자인과 (b-f) 패턴 위에 세포를 배양했을 때 처음에는 표면 전체에 붙는 듯 하지만, 배양 시작후 5시간 뒤부터는 세포가 이동성을 보이기 시작하여 15시간 이후에는 확연하게 세포가 붙은 영역과 붙지 않는 영역을 보여준다. 나노구멍 간격이 촘촘한 영역에 붙어있던 세포들은 간격이 넓은 영역으로 경향을 띄면서 이동하는 모습을 보인다. <그림 3> (a) 간격 구배를 갖는 나노구멍 패턴 위에 붙어있는 세포의 모습 (b) 패턴 위에서 자라는 세포는 그림a의 가로축을 기준으로 45도 방향으로 이동하는 방향성을 보이지만, (c) 패턴이 없는 곳의 세포는 이동에 경향성을 보이지 않는다. (d) 패턴 위의 세포를 형광 염색해서 현미경으로 관찰하였을 때, (e) 나노구멍 위에 붙어있는 세포의 초점접착역은 안정화되지 못하고 나노구멍을 피해서 작은 크기로 형성되는 반면, (f) 패턴이 없는 곳의 세포는 길쭉한 형태의 안정된 초점접착역을 보여준다. <그림 4> 나노구멍 패턴을 이용하여 세포들을 (a) 띠 형태, 혹은 (b) 원형으로 패터닝 할 수 있다.
- 1
- 작성자생체재료연구단 전호정 박사
- 작성일2015.07.28
- 조회수24443
-
0
암세포에만 작용하는 신개념 항암물질 개발, 방사선 치료 최소화 길 터
암세포에만 작용하는 신개념 항암물질 개발, 방사선 치료 최소화 길 터 - 기존 방사선 양의 1/6로 치료, 단백질과 항암제를 결합한 물질 제조해 부작용 최소화 - 과학자와 의학자의 협력을 통한 임상중개 공동연구의 결과 □ 암세포는 마치 살아있는 생물처럼 주변환경에 적응해 다양하고 복잡하게 진화한다. 이런 이유로 암세포는 약물 및 방사선 치료에 내성이 생겨 더욱 독성이 높은 치료가 요구되는 등 악순환이 이어진다. 국내 연구진이 기존의 독성이 큰 항암제와 단백질을 합성하여 암세포에만 작용하는 새로운 치료제를 개발했다. 개발된 치료제는 소량의 방사선 치료만으로 암조직에서만 활성화되고 지속적으로 약물효과를 발휘해 부작용이 컸던 암 치료의 새로운 패러다임을 제시했다. o 한국과학기술연구원(KIST, 원장 이병권)은 KIST 의공학 연구소 권익찬 소장과 울산의대 서울아산병원 김상윤 교수 공동 연구팀이 MD-PhD 협력 프로그램인 KIST-서울아산병원 중개연구로 “기존 방사선 치료의 1/6수준으로 암세포사멸을 유도하고 연구팀이 제작한 신개념 항암물질을 주사하여 부작용을 최소화한 항암치료법을 개발했다”고 밝혔다. □ 암세포는 스스로 진화하여 복잡하고 다양해 하나의 약물이나 치료방법으로는 완벽히 치료하기 어렵다. 연구진은 암세포 내에 특정 표현형을 유도하고, 약물이 유도된 특정 표현형을 선택적으로 표적화한다면 암의 복잡/다양성을 극복할 수 있음을 알아내고 특정 표현형에 의해 선택적으로 활성화되는 항암제를 사용하는 암치료 기술을 개발하였다. o 연구팀은 효과는 크지만 독성이 큰 기존 치료제의 한계를 극복하기 위해 치료제 구조를 변형한 펩타이드 기반의 새로운 약물을 개발했다. 개발된 약물은 펩타이드 기반의 약물로 단백질과 암세포를 공격하는 약물로 구성되어 외부의 자극이 없을 때는 활성화되지 않아 인체에 무해하다. 개발된 약물은 세포가 특정 표현형으로 유도되어 사멸되면서 분비되는 효소(caspase-3)와 만나면 암세포를 공격하는 약물이 분리된다. 이렇게 분리된 약물은 암세포를 집중적으로 괴사시켜 항암치료 효과가 나타나게 된다. o 이처럼 약물을 활성화하기 위해 필수적인 효소분비를 위해 연구팀은 부작용이 적은 약한 강도의 방사선을 이용했다. 그 결과 기존 암 치료의 6분의 1의 소량의 방사선만으로 세포가 사멸되어 효소분비를 유도할 수 있었고, 이 효소를 통해 약물이 활성화되는 것을 확인했다. o 개발된 물질의 더욱 큰 장점은 이렇게 활성화된 약물이 암세포를 사멸시키고 이 과정에서 효소가 다시 분비되어 추가 방사선 치료 없이도 약물의 효과가 지속적으로 나타난다는 것이다. □ 본 연구는 의사와 과학자의(MD-PhD)협력연구인 중개연구(Translational Research)의 성과라는 점에서 더욱 의미를 찾을 수 있다. KIST 의공학연구소는 지난 2011년 11월 공동 교신저자인 서울아산병원 이비인후과, 두경부암 전문 김상윤 교수를 중개연구프로그램 연구책임자로 초빙해 공동연구를 진행하고 있다. 또한 의사 출신 국내 임상 중견과학자로 2014년 6월에 경북의대에서 KIST 의공학연구소로 옮긴 김인산 박사가 논문 공동저자로 참여했다. KIST 의공학연구소에서 추진하고 있는 중개협력연구는 연구소의 원천기술을 임상에 적용하여 실용화하고 이를 바탕으로 다시 의공학 첨단기술을 개발하는 선도적인 협력모델로 자리잡고 있다. □ 권익찬 박사와 김상윤 교수는 “개발한 기술은 항암제의 효과가 암세포에서 집중적으로 나타나기 때문에 기존의 항암제가 가지고 있던 부작용을 현저히 낮춘 항암치료가 가능할 것으로 기대된다”고 밝혔다. o 본 연구는 미래창조과학부의 바이오?의료기술개발사업 및 KIST 의공학연구소 플래그쉽 연구 사업의 지원으로 수행되었으며, 연구결과는 의학 분야의 국제 저명 학술지인 미국 국립암연구소저널 (Journal of National Cancer Institute)에 12월 12(금)일자 온라인판에 게재되었다. * (논문명) Induced Phenotype Targeted Therapy: Radiation-Induced Apoptosis Targeted Chemotherapy - (공동 제1저자) (울산의대, 한국과학기술연구원) 이범석박사, (한양대학교) 조용우 교수 - (공동 교신저자) 울산의대 서울 아산병원 김상윤 교수, 한국과학기술연구원 권익찬 박사 <그림설명> <그림 1> 특정 표현형 유도 후 선택적으로 활성화되는 항암제를 사용하는 암 치료 시스템의 개념도. 암세포를 특정 표현형으로 발현시키기 위해 방사선을 암 조직에 조사하여 세포사멸을 유도하였다. 세포사멸의 결과로 caspase-3 효소가 암조직에 발현되고, 이는 DEVD 서열의 펩타이드를 분해하여, DEVD 펩타이드 기반의 약물전달체를 활성화하게 된다. 활성화되어 분리된 독소루비신은 세포의 핵내로 이동하여 항암 효과를 나타내게 된다. <그림2> 방사선 조사 유무에 따른 펩타이드 기반의 약물과 기존 항암제의 세포내 거동을 보여주는 형광현미경 이미지. 약물전달체가 처리된 세포에 방사선을 조사하여 유도된 세포사멸 결과 발현된 caspase-3는 펩타이드 기반의 약물을 활성화시키고, 분리된 약물은 세포핵내로 침투하여 약효를 나타낼 수 있다. <그림3> 특정 표현형 유도 후 선택적으로 활성화되는 항암제를 사용하는 암 치료 시스템의 항암 효과를 보여주는 그래프. 방사선을 조사한 후 펩타이드 기반의 약물을 전달한 경우(pink) 종양의 억제효과가 가장 우수하게 나타남. 기존 약물을 주사한 생쥐의 경우 독성으로 5일만에 죽었다. <그림4> 특정 표현형 유도 후 선택적으로 활성화되는 항암제를 사용하는 암 치료 시스템의 항암 효과를 보여주는 형광영상 이미지. 방사선을 조사한 후 펩타이드 기반의 약물을 전달한 경우 종양부위에서 강한 형광 영상이 나타나고 있으며, 그렇지 않은 동물의 종양부위에서는 형광영상이 나타나지 않고 있다. [첨부] 연구결과 개요, 용어 설명, 그림 설명, 연구진 이력사항
- -1
- 작성자의공학연구소 권익찬 소장 연구팀
- 작성일2015.01.15
- 조회수29526
-
-2
뇌, 척추 등 미세한 수술이 가능한 차세대 수술 로봇 개발
뇌, 척추 등 미세한 수술이 가능한 차세대 수술 로봇 개발 - 능동 캐뉼라 로봇으로 기존 대형수술로봇의 한계 극복 - 다양한 수술환경에서 집도의, 보조의 역할 수행 가능 한국과학기술연구원(KIST, 원장 이병권) 바이오닉스 연구단과 연세대학교 세브란스 병원(병원장 윤도흠)은 기존의 대형수술로봇으로는 적용할 수 없었던 ‘미세’한 수술영역에 적용이 가능한 차세대 미세수술용 능동 캐뉼라(active cannula) 로봇을 개발했다고 밝혔다. ※캐뉼라 : 의료용으로 쓰이는 금속으로 된 직선형 관, 능동 캐뉼라는 이것이 모터로 구동이 되어 조향(steering), 즉 방향 조정이 가능하도록 한 것임 개발된 능동 캐뉼라 로봇은 슬림화, 고강성화, 조향성 강화 및 소형화를 목표로 개발되었다. 인체내 삽입되는 부분의 외경이 4mm급으로 매우 가늘며, 상하좌우로 90도 구부러짐이 가능한 동작 범위를 가져 기존의 직선형 수술도구로는 접근이 불가능한 뇌의 깊숙한 영역까지 접근이 가능하도록 한 것이 특징이다. 연구팀은 또한 500g의 무게를 안정적으로 지지 할 수 있는 견고한 고강성(high stiffness) 조향 기구부를 개발하였다. 이러한 동작 성능은 기존 수술 미세 로봇들에서는 구현하기 힘들었던 기술이다. 연구팀은 로봇의 끝단에 종양조직을 적출할 수 있는 겸자(forceps)를 장착하였다. 수술 집도의의 양팔, 손목, 손가락의 모션을 모방한 조종장치를 통해 로봇과 겸자를 자유롭게 조종할 수 있도록 하여 수술 도구의 방향 전환 성능을 강화하였다. 아울러 수술 집도의와 보조의간의 협업이 용이하도록 로봇 몸체를 소형화하여, 비좁은 수술환경에서 쉽게 이동, 설치가 가능하고, 의료진의 움직임을 방해하지 않고 수술을 보조하도록 설계했다. KIST 능동 캐뉼라 로봇이 실제 사용을 위해 협력한 곳은 연세대학교 세브란스 병원의 김선호 교수팀. 김선호 교수팀에서 실시하는 수술은 최소침습 뇌종양 수술이다. 이는 환자의 얼굴의 중심부분에 위치한 뇌하수체 부근에 위치한 종양을 두개골의 절개 없이 코를 통하여 젓가락과 같이 가늘고 긴 수술도구를 넣어 종양을 제거하는 수술이다. KIST에서 개발한 미세수술로봇은 수술 보조사로서, 기존의 수술도구로는 접근할 수 없었던 영역에 수술 로봇이 접근하여 의사의 양손을 대신하여 수술을 진행한다. KIST와 연세대학교는 올해 6월에 1차 카데바(사체) 실험을 통해 실제 수술에서 활용성과 기능성이 개선된 수술로봇으로 11월 2일 세브란스 병원에서 2차 카데바 실험을 진행했다. KIST 강성철 박사는 “이번에 개발한 수술로봇은 컴팩트한 사이즈와 다자유도의 조향성능으로 인해 기존의 수술로봇을 사용할 수 없는 신경외과, 안과, 정형외과 등의 뇌수술, 척추수술, 안구수술 등 미세수술 영역에 광범위하게 사용 가능할 것으로 기대된다”며 “향후 협력연구와 임상실험을 통해 미세 수술로봇이 실제로 환자들에게 쓰일 수 있도록 노력하겠다”고 밝혔다. 본 수술로봇 연구에는 KIST 의공학연구소 바이오닉스 연구단의 강성철, 이우섭, 김계리 박사가 주관하였고 연세대학교 의과대학 세브란스 병원 신경외과의 김선호 교수와 KAIST 기계공학과의 권동수 교수가 공동으로 참여하였다. <참고 그림자료> 그림 1. 고강성 조향 기구부 설명도 그림 2. 제1차 카데바 실험 (2014년 6월15일, 세브란스 병원) 그림 3. 2차 프로토 타입 로봇을 이용한 뇌하수체 종양 수술 시연 (연세대학교 의과대학 세브란스 병원 김선호 교수)
- -3
- 작성자KIST 바이오닉스연구단 선임연구원 이우섭
- 작성일2014.11.03
- 조회수39388
-
-4
체내에서 녹는 뼈고정용 의료기기 임상시험 승인
체내에서 녹는 뼈고정용 의료기기 임상시험 승인 - KIST, 유앤아이(주) 등이 참여한 산학연 컨소시엄은 서울시 산학연협력사업 과제를 통해 체내에서 용해되는 정형/성형외과용 의료기기의 임상시험 승인 - 개발 제품은 손상 골조직의 복원 후 의료기기를 제거할 필요 없는 새로운 개념의 뼈고정용 의료기기로서 의료기술의 새로운 개념 제시 - 막대한 규모의 미래 의료기기 시장을 선도할 신기술로서 미래 고부가가치 먹거리 개발 기대 - 연구결과는 세계적 유명 학술지 Nature 자매지 Scientific Report 8월호 게재 서울시의 대표적인 중소기업 R&D지원 프로그램인 서울전략산업 지원사업의 집중적 지원에 힘입은 한국과학기술연구원(KIST) 컨소시엄은 체내 이식 후 분해되는 새로운 금속소재를 개발하고, 이를 이용하여 정형/성형외과용 뼈 고정 장치를 개발한 후 한국식약청으로부터 임상시험 승인을 받았다. 유앤아이(주), 서울아산병원, 서울대학교 등이 공동으로 참여하는 한국과학기술연구원 컨소시엄(컨소시엄 총괄책임자; KIST 의공학연구소 석현광 박사)은 2010년도에 서울시 서울전략산업 지원사업에 선정되어 현재 3차년도 개발 진행 중이다. 생분해성 금속은 체내 이식 후 일정 기간(6개월-2년)이 경과하면 분해되어 체내에서 소멸되는 소재로서, 이러한 소재를 이용하여 의료기기를 제조하면 손상된 인체조직이 복원된 후 이식된 의료기기를 제거하는 2차 시술을 생략할 수 있기 때문에 특히 골절치료 분야의 새로운 장을 열 것으로 기대된다. KIST 컨소시엄은 인체 무해한 원소로만 구성된 저분해속도/고강도 생분해성 금속을 개발하였다. 또한 정형/성형외과용 생체분해성 의료기기를 제조하여 환자를 대상으로 하는 임상시험 승인을 획득하고, 현재 아주대학교 병원에서 임상시험을 수행하고 있다. 본 연구개발의 핵심은 금속의 기지조직과 기지조직에 분포되어 있는 제 2 상 사이의 화학적 포텐셜을 일치시키는 방법을 통해 생분해성 금속소재가 갖는 치명적 한계인 과도한 분해속도 문제를 해결한 것이며, 이 원리를 적용하여 제 2, 3의 원소가 첨가된 합금(Alloy)이지만 순(pure)금속과 동일한 전기화학적인 특성을 갖는 새로운 개념의 신소재를 개발할 수 있었다. 컴퓨터 시뮬레이션 기술과의 접목을 통해 이룬 이번 쾌거는 국민대 전산모사팀(책임자 차필령 교수)의 참여로 이루어졌다. 이는 학문적인 관점에서도 매우 획기적인 발견으로 평가 되며, 연구 결과는 Nature 자매지인 Scientific Report 2013년 8월호에 게재되었다. 생체분해성 금속으로 제조된 생분해성 정형/성형외과용 뼈고정장치는 천문학적인 규모의 미래형 의료기기 시장을 형성할 수 있는 원천기술이다. 본 연구성과는 18,000개의 진공관으로 구성된 최초의 전자식 컴퓨터인 ENIAC(애니악)이 컴퓨터 역사에서 차지하는 의미와 비교할 수 있다. 즉, 생분해성 금속을 환자에게 적용가능하다는 것을 증명한 중요한 사건인 동시에 향후의 생분해성 금속의료기기에 대한 본격적 연구를 가능하게 하는 계기가 될 것이다. 서울전략산업 지원사업은 서울시의 대표적인 R&D 지원사업으로 서울의 전략산업인 IT융합과 Bio메디컬 분야의 산학연컨소시엄 과제를 최대 4년간 지원하며, 지금까지 학술논문, 특허출원, 인력양성, 해외진출 등의 성과를 이루었다. 서울전략산업 지원사업은 서울시가 전략적 과제를 지정한 후 기업들을 모집하는 방식으로 추진되었으며, IT나 BT 분야의 융복합 과제에 대해 4년간 과제당 40억원을 집중 지원하여, 2010년부터 현재까지 10개 과제를 통해 SCI논문 18건, 특허출원 55건, 특허등록 6건, 인력양성 395명, MOU체결을 통한 해외진출 등의 성과를 이루었다. ○ 연구진 <석현광 박사> ○ 그림설명 <그림1> 동물 뼈조직에 시술 한 후 시간이 경과하면서 체내에서 녹아 점차 소멸되고 있는 생체분해성 금속의 실제 단층촬영 이미지 <그림2> 동물 뼈 조직 내 시술 6개월 후 주변 뼈조직과 결합되어 있는 생체분해성 의료기기 실제 단층 촬영 이미지 <그림3> 개발된 생체분해성 뼈고정용 의료기기 예 <그림 4> 개발된 생체분해성 의료기기를 사용하여 골절된 손가락 뼈를 고정하는 시술 개념도 <그림5> 세계적 학술지인 Nature 자매지 Scientific Report지 게재 논문
- -5
- 작성자의공학연구소 생체재료연구단 석현광 박사
- 작성일2013.08.19
- 조회수39892
-
-6
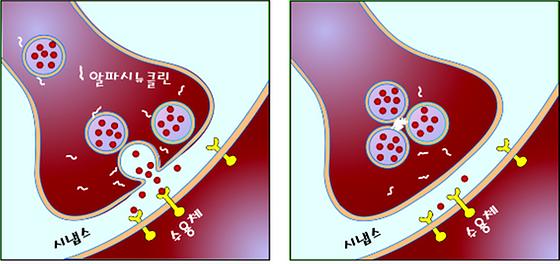
치매의 원인을 밝혀내다
치매의 원인을 밝혀내다 - KIST-포스텍-성균관대 공동연구팀, 뇌 활동을 저해하는 단백질의 기전 규명, 치매 원인 밝혀내 - 치매 예방 및 치료의 새로운 방향 제시 전체 치매환자 중 약 30%는 알파시뉴클린(alpha-synuclein)이라는 뇌신경세포 단백질의 변질에 의해 발병된다고 알려져 있다. 알파시뉴클린은 건강한 뇌세포에서는 뇌의 활성을 도와주는 이로운 물질이지만 자기들끼리 서로 엉키게 되면 치명적인 독소로 변해 치매, 파킨슨병 등 다양한 퇴행성 뇌질환을 일으키는 두 얼굴을 가진 물질로 알려져 왔다. 하지만 지금까지 이 독소체가 어떠한 방법으로 뇌세포 활동에 해를 끼쳐 치매를 일으키는지는 알려져 있지 않았다. 한국과학기술연구원(KIST, 원장 문길주) 의공학연구소 테라그노시스연구단 신연균 교수(KIST 겸직연구원, 아이오와 주립대 교수), 포스텍(총장 김용민) 시스템생명공학부 이남기 교수, 성균관대(총장 김준영) 유전공학과 권대혁 교수 공동연구팀은 하나의 포낭 주머니가 세포막에 융합되는 과정을 실시간으로 관찰할 수 있는 첨단 단분자 융합 연구방법을 이용, 알파시뉴클린 응집독소체가 뇌 활동의 가장 중요한 부분인 시냅스에서의 신경전달물질 분비를 저하시켜 기억 및 인지 활동의 저해를 가져와 치매를 유발할 수 있다는 사실을 발견했다고 밝혔다. 이번 연구 성과는 치매의 원인을 규명한 획기적인 것으로 관련 내용은 19일 미국국립과학원회보(PNAS) 온라인 판에 게재되었다. 시냅스에서의 신경전달물질 분비는 이를 저장하는 포낭 주머니가 뇌세포막에 융합하여 일어난다. 공동연구팀은 스내어(SNARE)라는 단백질이 어떠한 과정을 통해 개개의 포낭을 세포막에 융합시키고 그 융합과정을 조정하는지를 단계별로 분리 측정하는데 성공하였다. 이 과정에서 알파시뉴클린은 정상적인 상태에서는 스내어 단백질을 돕는 역할을 하지만(왼쪽 그림), 여러 개가 엉켜 독소로 탈바꿈하면 스내어 단백질에 들러붙어 이들의 세포막 융합 활성을 무력화 시키는가 하면, 여러 개의 포낭 주머니들을 응집하도록 만들어 시냅스로의 신경전달물질 분비를 급격히 저하시킨다는 것을 알아냈다(오른쪽 그림). 이는 시냅스의 신경전달 기능을 약화시키고 뇌의 기억 및 인지 활동의 약화를 가져오게 된다. KIST 신연균 교수는 "이번 발견은 치매를 효과적으로 예방하고 치료할 수 있는 새로운 방향을 제시해 준다는데 큰 의미가 있다" 며 "치매 유발의 또 하나의 중요 인자인 베타아밀로이드(beta-amyloid)라는 단백질 또한 비슷한 메커니즘을 통해 치매를 유발할 것으로 보이며, 스내어 단백질의 무력화가 대다수의 치매 발병의 근본적 원인 중의 하나일 것으로 예상된다" 고 말했다. 한편 신연균 교수는 단분자 이미징과 EPR(Electron Paramagnetic Resonance)을 이용한 단백질 구조분석에 원천기술을 보유한 점을 높게 평가받아 KIST 의공학 연구소의 해외 과학자 유치사업을 통해 지난 2011년, KIST로 초빙되었다. 신 교수는 KIST의 전폭적 지원하에 KIST 내에 기초 연구를 수행할 수 있는 연구실을 구축하고 신경 전달과정 매커니즘에 관한 연구를 진행중이며 이를 통해 치매 등 정신질환 연구에서 세계를 선도하는 원천기술 확보를 위해 매진하고 있다. 이번 연구는 KIST 및 교과부, 미국국립보건원(NIH)의 연구비 지원으로 수행되었다. ○ 연구진 ○ 그림설명 (좌) 정상뇌세포에서 포낭 주머니가 세포막에 융합되어 신경전달물질이 시냅스로 분비되고 이를 다음 뇌세포막에 있는 수용체가 인지하게 되어 뇌세포간의 신경전달이 이루어진다. (우) 치매환자의 경우 알파시뉴클린 응집독소체가 포낭 표면의 스내어 단백질에 들러붙어 포낭 엉킴을 일으켜 포낭 융합을 방해하고 신경전달을 마비시킨다.
- -7
- 작성자의공학연구소 테라그노시스연구단 신연균 박사
- 작성일2013.02.19
- 조회수32581
- 첫 페이지로 이동하기
- 이전 페이지로 이동하기
- 1
- 2
- 3
- 4
- 5
- 6
- 7