연구본부소개
-
68
항암제 내성 생긴 흑색종, 그 원인 찾았다
- 흑색종의 억제 표적 항암제(BRAF)에 내성을 가지는 핵심 기전 규명 - 폴리아민 생합성 조절로 내성 억제, 치료 효과 높은 신규 항암제 개발 기대 흑색종은 피부 속 색소를 만들어 주는 멜라닌 세포가 일으키는 암으로, 전이나 재발이 쉽게 발생해 피부암 중 가장 치명적인 암으로 알려져 있다. 전 세계적인 고령화 추세로 인해 흑색종 환자가 빠르게 늘어 2040년에는 매년 세계에서 약 10만 명이 흑색종으로 사망할 것으로 보고된다. 현재 임상에서는 BRAF(비라프)라는 발암 유전자를 억제하는 표적 항암제로 흑색종을 치료하고 있지만, 약물에 대한 내성이 빠르게 발생해 치료 효과가 높지 않다는 한계가 있다. 한국과학기술연구원(KIST, 원장 오상록) 의약소재연구센터 김택훈 박사 연구팀은 흑색종이 BRAF 억제 항암제에 대한 내성을 가지게 되는 핵심 기전을 새롭게 규명하고, 내성 발생을 억제할 수 있는 새로운 항암제 개발 전략을 제시했다고 밝혔다. 연구팀은 BRAF 항암제에 내성을 지닌 세포주 모델을 이용해 AMD1 유전자의 활성이 항암제 내성을 가지는 데 중요한 역할을 하고 있음을 발견했다. AMD1 유전자는 세포의 성장과 증식을 촉진하는 폴리아민(polyamine) 생합성에 필수적인 역할을 하는데, 일반적으로 암세포에서 폴리아민이 더 높은 수준으로 나타난다. 실험을 통해 이 유전자의 활성을 조절한 결과, 폴리아민 생합성을 억제하면 BRAF 항암제에 대한 내성도 낮아져 흑색종이 사멸됨을 확인했다. 이를 바탕으로 항암제 내성 흑색종에서 발암 유전자인 c-Myc이 폴리아민 생합성의 증가를 유발하고 있음을 밝혔다. 이렇게 증가된 폴리아민이 미토콘드리아 단백질의 양을 증가시켜 미토콘드리아 활성을 높이며, 이로 인해 항암제에 내성을 지닌 암세포의 증식으로 이어지는 과정이 흑색종 항암제 내성 발생 핵심 기전임을 규명했다. 이번 연구는 기존에 거의 알려지지 않았던 폴리아민 생합성이 BRAF 항암제 내성 유발의 원인임을 밝힌 세계 최초의 연구이며, 나아가 KIST 연구팀은 BRAF 항암제에 대한 내성을 극복하기 위해 내성 기전의 각 단계를 억제하는 항암제 개발 전략을 제시했다. 본 연구를 통해 항암제 내성이 빈번하게 발생해 완치가 어려웠던 흑색종을 치료할 수 있는 폴리아민 대사 조절 기반의 신규 항암제 개발이 가능해졌다. 이를 통해 2028년 10억 달러 규모로 전망되는 BRAF 억제 항암제 시장에 적용가능한 선도 기술을 확보할 것으로 기대된다. KIST 김택훈 박사는 “가장 치명적인 피부암인 흑색종의 항암제 내성 발생의 핵심 기전을 규명했다”라며, “대사항암제 개발을 위해 BRAF 돌연변이가 자주 나타나는 대장암, 갑상선암 등에서 폴리아민 대사 조절을 통한 항암 효과 검증을 수행할 예정”이라고 말했다. 본 연구는 과학기술정보통신부(장관 유상임)의 지원을 받아 KIST 주요사업 및 중견연구자지원사업(2021R1A2C1093499), 바이오의료기술개발사업(RS-2024-00400042), 국가과학기술연구회 선행융합연구사업(CPS23011-100) 및 창의형 융합연구사업(CAP23011-000) 등으로 수행됐다. 이번 연구 성과는 국제 학술지 ‘Molecular Cancer’(IF 27.7, JCR 분야 상위 1.1%)에 최신 호에 게재됐다. [그림 1] 폴리아민 생합성 억제를 통한 BRAF 억제 항암제 내성 극복 (위) 흑색종은 BRAF 억제 항암제 투여에도 항암제 내성이 발생하여 암이 재발함. (아래) 폴리아민 생합성 억제와 BRAF 억제 항암제를 조합하면 암의 재발을 막고 완치 가능성이 증가할 수 있음. [그림 2] BRAF 억제 항암제 내성 발생 기전 BRAF 억제 항암제 내성 흑색종은 c-Myc 발암유전자 활성에 의해 AMD1을 비롯한 폴리아민 생합성이 증가하여 결국 미토콘드리아의 활성이 증가하여 항암제 내성을 유도함. 본 연구에서는 폴리아민 생합성 저해를 통해 이 기전을 막음으로써 항암제 내성을 극복하였음.
- 67
- 작성자의약소재연구센터
- 작성일2024.09.11
- 조회수3051
-
66
치료 표적 없는 비흡연 폐암 치료의 길 열린다
- 유전체, 전사체, 단백체 및 임상 데이터의 통합으로 정밀의학적 특성 규명 - 순수 국내 연구진의 공동연구로 한국인 특이적 난치 암의 신규 치료 표적 발굴 폐암의 가장 주요한 원인은 흡연이다. 그런데 비흡연자의 폐암 발병률은 꾸준히 증가하고 있으며, 특히 여성의 발생률이 높다. 비흡연 폐암 환자의 약 80%는 EGFR 및 ALK 단백질 등을 표적으로 하는 항암제가 처방되고 있지만, 표적이 없는 나머지 환자는 부작용이 많고 항암제 반응률이 상대적으로 낮은 세포독성 항암제를 사용하고 있어 표적치료제가 절실한 상황이다. 한국과학기술연구원(KIST, 원장 오상록) 화학생명융합연구센터 이철주 박사팀은 한국생명공학연구원의 김선영 박사팀, 국립암센터의 한지연 박사팀과 한국인 특이적 비흡연 폐암의 에스트로겐 신호전달 체계 과발현 현상을 다중오믹스 기반으로 규명하고, 항암제 사라카티닙(saracatinib)을 표적 치료 물질로 제시했다고 밝혔다. 다중오믹스는 유전체, 단백체 등 다양한 분자 정보를 통합해 총체적인 정보를 제공하는 기술로, 단백체의 경우 미량의 시료를 대량으로 복제하는 기술이 없어 수십 마이크로그램(μg, 100만분의 1그램) 수준의 미량 단백질을 최대한 손실 없이 분석해야 하는 고난이도 분석법이다. 연구팀은 지난 10여 년간 국립암센터에 내원한 비흡연 폐암 환자 1,597명의 생체검사 시료의 유전자 분석을 통해 치료 표적이 발견되지 않는 비흡연 폐암 환자 101명의 폐암 조직을 확보했다. 이후 임상 정보와 유전체, 전사체, 단백체, 인산화 단백체 데이터를 각각의 오믹스 분석법에 분배하는 방법으로 데이터를 상호참조할 수 있게 했다. 특히 단백체 분석에서는 동중원소표지법을 이용해 기존 단백질 분석에 필요한 양의 10%인 100μg의 단백질만으로도 시료 당 평균 9천여 종의 단백질과 5천여 종의 인산화 단백질의 양을 측정했다. 유전자변이 및 암세포의 신호전달 경로를 측정한 결과, 암 발생과 관련된 유전자로 알려진 STK11와 ERBB2의 운전자 돌연변이(driver mutation)가 비흡연 폐암 환자의 조직에서 다수 관찰됐으며, 여성호르몬인 에스트로겐 신호전달 경로가 과발현됐지만 호르몬 수용체 자체는 큰 변화가 없는 것을 확인했다. 이를 바탕으로 호르몬 치료제가 아닌 하위 신호전달 단백질 저해제인 사라카티닙을 STK11와 ERBB2의 변이가 있는 세포에 적용한 결과, 대조군 대비 통계적으로 유의미(p<0.01)한 세포 사멸 효과가 있음을 관찰했다. 이를 바탕으로 연구팀은 비흡연 폐암 환자 중 에스트로겐 신호전달경로에 특이적 발현을 보이는 환자의 감별진단이 가능한 분자 진단 기술을 개발하고 있다. 또한, 비흡연 폐암 동물모델에 대한 사라카티닙의 치료 효과 분석을 위해 국립암센터와 전임상 시험을 공동으로 진행할 계획이다. KIST 이철주 박사는 “다중오믹스 분석으로 난치암의 새로운 치료 표적을 발굴한 성공적 사례”라며, “순수 국내연구를 기반으로 병원과 연구기관이 공동연구를 통해 이룬 성과라는 점에서 큰 의미가 있으며, 이러한 경험을 바탕으로 인간 질병에 대한 다중오믹스 연구의 확장에 앞장설 것”이라고 밝혔다. 본 연구는 과학기술정보통신부(장관 이종호)의 지원으로 KIST 주요사업 및 바이오의료기술개발사업(2022M3H9A2096187)으로 수행됐다. 연구 성과는 국제 학술지 「Cancer Research」 (IF 11.2, JCR 분야 10.6%)」 최신 호에 온라인 게재됐다. * 논문명 : Proteogenomic Characterization Reveals Estrogen Signaling as a Target for Never-Smoker Lung Adenocarcinoma Patients without EGFR or ALK Alterations [그림 1] 비흡연폐암 유전단백체 분석 연구의 개요 [그림 2] 미확인 변이를 가지는 환자의 대표 특징 및 변이 유전자 동정
- 65
- 작성자화학생명융합연구센터
- 작성일2024.05.13
- 조회수3093
-
64
맞춤형 암 치료 가능한 암 백신의 등장 머지 않았다
- DNA 오리가미 기술을 활용한 차세대 암백신 ‘DoriVac’ 개발 - KIST-DFCI, 보스턴 클러스터에 현지랩 설립 후 7년간의 공동 연구 성과 최근 암 치료 분야에서 암세포를 직접 파괴하는 항암제와는 다르게 면역시스템을 강화해 특정 암세포를 공격하는 암 백신에 관한 관심이 높아지고 있다. 암 백신은 환자의 개별적인 항원을 고려한 맞춤형 치료를 제공할 수 있지만 특정 암종이나 환자의 면역 상태에 따라 치료 효과가 제한적이다. 또한, 부작용을 일으킬 수 있는 면역증강제의 사용을 최소화해 안전성을 확보하는 것이 중요하다. 한국과학기술연구원(KIST, 원장 오상록) 의약소재연구센터 류주희 박사팀은 미국 보스턴의 다나파버 암 연구소(DFCI) 및 하버드 비스 연구소(Wyss Institute)와 협력해 DNA 오리가미 기술을 활용한 암 백신 ‘DoriVac’을 개발했다고 밝혔다. DoriVac(도리백, DNA origami-based Vaccine)은 기존의 항원과 면역증강제를 동시 전달하는 암 백신 전략을 확장해 면역증강제인 CpG의 공간 배열을 정밀하게 조절한 차세대 암 백신이다. 연구팀은 암 백신 개발을 위해 DNA 오리가미 기술로 면역증강제인 CpG를 DNA 나노구조체 표면에 최적의 공간 배열로 배치했다. DNA 오리가미 기술은 DNA 분자를 마치 종이처럼 접어 다양한 형태를 만들 수 있으며 나노미터(nm, 10억분의 1미터) 단위에서도 구조를 세밀하게 제어할 수 있다. 이를 활용해 DNA 나노구조체 표면에 CpG 분자들을 2.5~7nm 간격으로 정밀하게 배열했으며, 세포 실험 결과 3.5nm 간격일 때 암 면역 치료 효과가 가장 높았다. 연구팀이 수행한 동물실험에서 DoriVac이 주입된 후 피부암이 유도된 5마리의 쥐 중 1마리를 제외하고 모두 150일까지 생존했지만, 아무것도 주입되지 않은 쥐는 42일째에 모두 사망해 DoriVac이 공격적인 피부암 세포의 성장을 억제하는 예방적 효과가 있음을 확인했다. 또한, 피부암이 형성된 초기 단계의 쥐들에게 3.5nm 간격으로 18개의 CpG 분자가 포함한 DoriVac을 투여했을 때, 가장 효과적인 면역 반응을 유도해 종양 성장을 크게 억제했다. 이는 면역증강제 양을 증가시키지 않고 정밀한 공간 배열 조정만으로도 암 백신의 치료 효과를 높일 수 있다는 사실을 밝혀낸 것이다. 이번 연구는 미국 보스턴에 설립된 KIST-DFCI 현지랩에서 2016년부터 수행된 공동연구의 결과로 KIST가 가지고 있는 항암 치료 전략기술과 DFCI의 DNA 오리가미 기술에 대한 전문성을 기반으로 이뤄졌다. 글로벌 공동 연구팀은 ‘DoriNano Inc’를 보스턴에서 공동 창업해 DoriVac의 상용화를 위한 임상 시험을 추진하고 있으며, 면역관문억제제 등 다른 면역 시스템을 활용하는 암 치료 방법과의 병용을 통해 암 치료 및 재발 방지 효과를 높일 것으로 기대된다. KIST 류주희 박사는 "DoriVac의 개발은 나노기술과 암 면역 치료 기술이 융합된 중요한 발전이며, 이는 암 치료뿐만 아니라 다양한 질병에 대한 면역 치료법 개발에 기여할 수 있는 플랫폼 기술이 될 것"이라고 밝혔다. [그림 1] DNA 오리가미 기반의 백신 작용 원리 [그림 2] KIST 의약소재연구센터 류주희 박사(책임연구원)가 다나파버 암 연구소(DFCI) 등과 공동연구를 통해 DNA 오리가미 나노구조체를 활용한 혁신적인 암 백신 'DoriVac'을 개발했다. 본 연구는 과학기술정보통신부(장관 이종호)의 지원을 받아 KIST 주요사업과 범부처재생의료기술개발사업(21A0504L1)으로 수행됐다. 이번 연구 성과는 국제 학술지 「Nature Nanotechnology」 (IF 38.3, JCR 분야 상위 1.4%) 최신 호에 온라인 게재됐다.
- 63
- 작성자의약소재연구센터
- 작성일2024.05.02
- 조회수7140
-
62
땀으로 누구나 간편하게 질병 모니터링 가능해진다.
- 땀샘 자극 약물 전달과 생체 상태 모니터링이 동시에 가능한 플렉서블 디바이스 개발해 낭포성 섬유증 유아 환자 대상 임상 테스트 성공 - KIST-Northwestern University의 2년간 공동 연구 성과 땀에는 당뇨병부터 유전질환까지 다양한 건강 상태를 모니터링할 수 있는 바이오마커가 포함돼 있다. 땀 채취는 혈액 채취와 달리 통증이 없어 사용자들이 선호하는 방법이지만, 검사를 진행하기 위해 충분한 영양소나 호르몬을 땀에서 얻기 위해서는 격렬한 운동을 통해 충분한 땀을 배출해야 했다. 그런데 이런 방법은 운동기능이 제한적인 사람들에게는 적용되기 어렵다는 문제가 있었다. 한국과학기술연구원(KIST, 원장 오상록) 바이오닉스연구센터 김주희 박사, Northwestern University John A. Rogers 교수 공동연구팀은 피부 약물 전달을 통해 운동이 필요 없는 간편한 땀 모니터링 디바이스를 개발했다고 밝혔다. 운동을 통해 땀을 유도했던 기존 방법과 달리 피부를 통해 땀샘을 자극할 수 있는 약물을 전달해 땀을 유도하는 방식이다. 연구팀은 약물이 포함된 하이드로젤에 전류를 흘려 약물을 피부 밑 땀샘으로 전달할 수 있는 플렉서블(Flexible) 디바이스를 개발했다. 이 디바이스는 작고 부드러워 피부 위에 쉽게 부착할 수 있으며, 약물로 유도된 땀은 디바이스 내 마이크로 플루이딕 채널에 수집돼 바이오센서를 통해 생체 상태를 모니터링 한다. 이처럼 디바이스 부착만으로 땀 속의 바이오마커를 분석할 수 있어 병원을 방문해 검사받아야 하는 번거로움을 줄이고, 검사 과정에서 발생할 수 있는 바이오마커의 오염 가능성도 낮출 수 있어 정확도 또한 높일 수 있다. 연구팀이 개발한 디바이스를 낭포성 섬유증을 앓고 있는 아기에게 부착하고 땀 속의 바이오마커인 염소 농도를 확인한 결과, 병원에서 땀을 채취해 기존 분석 방법으로 진단한 결과와 98% 이상 일치했으며, 피부 온도 및 피부 pH 수치를 확인해 피부에 대한 디바이스 안정성을 확보했다. 낭포성 섬유증은 주로 유아기에 발현되기 때문에 질병 진행 및 신체 상태에 대한 지속적인 모니터링이 필요한데, 디바이스를 통해 집에서도 간편하게 모니터링할 수 있어 유아 환자와 보호자의 정신적·신체적 스트레스를 낮출 수 있을 것으로 기대된다. 이번에 개발된 디바이스는 건강한 성인도 별도의 운동 없이 간편하게 땀 속 바이오마커를 모니터링할 수 있어 비침습적 질병 모니터링 기술인 땀 기반의 디바이스 확대에 기여할 수 있다. 또한, 피부를 통해 약물을 전달하는 기술은 땀을 유도할 뿐만 아니라 피부질환, 피부 상처 등 국소적으로 약물 전달이 필요한 곳에서 약물 전달률을 높여 회복 속도를 높이는 데도 활용될 수 있다. KIST 김주희 박사는 “Northwestern University와 2년간 공동 연구를 통해 달성한 성과로 땀 모니터링 디바이스 개발에 있어 기존의 땀 유도 방식의 한계를 해결했을 뿐 아니라, 임상 연구에도 성공함으로써 상용화에 한 걸음 더 가까워진 연구 성과”라고 연구의 의의를 밝혔다. Northwestern University John A. Rogers 교수는 “앞으로 성인을 포함한 대규모 임상 연구 및 상용화를 위한 후속 연구를 진행할 계획”이라고 말했다. 본 연구는 과학기술정보통신부(장관 이종호)의 KIST 주요사업과 우수신진연구사업(RS-2023-00211342)으로 수행됐다. 이번 연구 성과는 국제 학술지 「Biosensors & Bioelectronics」 (IF 12.6) 최신 호에 온라인 게재됐다. * 논문명 : A skin-interfaced, miniaturized platform for triggered induction, capture and colorimetric multicomponent analysis of microliter volumes of sweat [그림 1] 땀을 유도하기 위한 피부 약물 전달과 땀 속 질병 모니터링이 동시에 가능한 웨어러블 소자의 모식도 및 실제 사진 약물 전달 시스템과 땀 속 바이오마커 모니터링을 한 번에 할 수 있는 디바이스의 모식도와 사진 [그림 2] 그림 1의 웨어러블 소자를 아이에게 부착하여 테스트하는 모습 아이의 왼쪽 팔에는 병원에서 기존에 쓰이는 유선 장비를 부착하고, 오른쪽 팔은 개발한 기기를 피부에 붙여 땀샘을 자극하는 약물을 전달하는 모습
- 61
- 작성자바이오닉스연구센터
- 작성일2024.04.24
- 조회수4155
-
60
환각 상태의 뇌는 어떻게 다를까?
- 다중감각 VR로 유도된 환각에 의한 인간 격자 세포 활성 변화 관측 - 유체 이탈 등 환각 증상에 대한 객관적 진단이나 치료의 새로운 방향 제시 한국과학기술연구원(KIST, 원장 오상록) 바이오닉스연구센터 문혁준 박사 연구팀은 스위스 로잔연방공과대학(이하 EPFL) 블랑캐(Olaf Blanke) 교수 연구팀과 함께 다중감각 가상현실(VR)을 이용해 자기 위치 환각을 유도하고, 이로 인한 뇌 속 격자 세포 활성의 변화 관측에 성공했다고 밝혔다. 우리 뇌에는 자신이 위치한 장소를 인지하는 GPS(위치정보시스템) 기능을 수행하는 격자 세포(grid cell)와 장소세포(place cell)가 존재하는 것으로 알려져 있다. 특정 장소로 이동하는 동안 그 경로에 있는 GPS 세포들이 위치에 따라 차례로 반응하게 되는데, 이들 세포는 우리의 위치를 좌표 형태로 인식하고 공간 내 사건들을 기억하는 데 중요한 역할을 담당한다. 인간은 상상이나 환각을 통해 실제로 몸을 움직이지 않아도 자신이 다른 공간에 있는 것처럼 인식하는 이른바 순수인지적 위치 이동이 가능한 존재다. 하지만, 이 같은 순수인지 과정에서 일어나는 뇌 속 GPS 세포의 반응은 이러한 인지를 유도하거나 확인할 수 없는 쥐 등의 동물실험으로는 관찰할 수 없었다. 더욱이 기존에 GPS 세포 연구를 위해서는 두개골을 열고 침습적 전극으로 개별 세포의 활성을 측정해야 했기 때문에 순수인지 과정의 인간 GPS 세포 활성에 관한 연구와 이해는 제한적일 수밖에 없었다. 연구팀은 순수인지적 환각에서 격자 세포의 활성을 관측하기 위해 MRI 호환 VR 기술과 다중감각 신체 신호 자극을 결합해 다양한 위치와 방향으로 자기 위치 변화 환각을 유도했다. 이 과정에서 측정된 MRI 신호를 통해 격자 세포의 변화를 분석했으며, 각 피험자의 환각 경험은 실험 후 질문지와 그들이 경험한 자기 위치를 확인할 수 있도록 고안된 행동 지표를 통해 확인했다. 그 결과, 연구팀은 환각에 의해 유도된 자기 위치에 대한 순수인지적 변화가 그에 상응하는 격자 세포의 활성을 일으킨다는 것을 최초로 증명했다. 이번 연구는 실제 위치의 이동 없이 다중 신체 감각 자극만으로 자기 위치 환각과 격자 세포 활성을 유도할 수 있다는 사실을 처음으로 입증한 임상시험 결과다. 이것은 인간 뇌 속 GPS 좌표가 신체의 물리적 위치뿐만 아니라 다양한 인지 활동과 경험에 따른 위치 정보에 반응한다는 것을 보여준 것으로 뇌 영상 분석을 통한 환각 증상의 객관적인 진단 가능성을 높였다. 또한, 이번 연구 성과가 유체 이탈 등의 환각 증상을 겪고 있는 환자들의 치료를 위한 표적을 제시해 새로운 치료법 개발에도 기여할 것으로 기대된다. KIST 문혁준 박사는 “1인칭 시점의 시각적 환경 단서의 변화에 의존해 왔던 기존 인간 격자 세포 연구와 달리 다중 신체 감각의 통합이라는 주요 연구 요소를 새롭게 제시했다”라며, “다양한 정신질환이나 신경 질환으로 인한 환각 증상의 뇌 기능적 메커니즘 이해를 통해 해당 증상을 억제할 수 있는 비침습적 신경 자극 치료를 개발하기 위한 후속 국제협력연구를 진행할 예정”이라고 밝혔다. [그림 1] 다감각 VR을 통한 통제된 자기 환각 유도와 이에 따른 격자 세포 활성 관찰 [그림 2] 내후각피질에서 관찰된 격자세포 활성 본 연구는 국내에서는 과학기술정보통신부(장관 이종호)의 지원으로 KIST 주요사업과 스위스 국립과학재단의 지원(320030_188798)으로 수행됐다. 이번 연구 성과는 국제 학술지 「PNAS」 (IF: 11.1)에 3월 게재됐다. * 논문명 : Changes in spatial self-consciousness elicit grid cell-like representation in the entorhinal cortex
- 59
- 작성자바이오닉스연구센터
- 작성일2024.04.15
- 조회수3092
-
58
중증하지허혈로 인한 절단 막는 줄기세포 치료제 개발
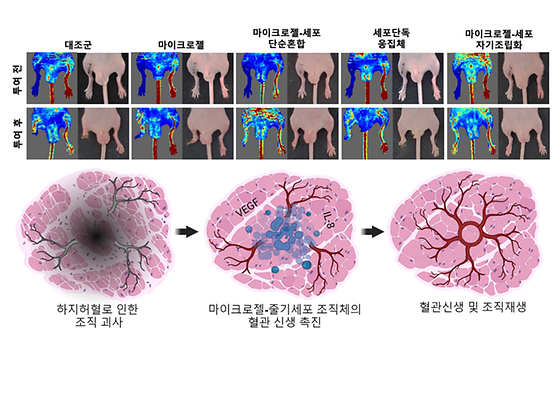
- 콜라겐 마이크로젤 신소재 기반 차세대 줄기세포 치료제 개발 - 우수한 생체적합성 및 세포 생존율로 중증하지허혈 치료 가능성 높여 중증하지허혈은 다리 부분에 혈액을 공급하는 주요 혈관이 막혀 발생하는 질환으로 말초동맥에 동맥경화증이 점차 심해짐에 따라 혈액 흐름이 서서히 줄어드는 질환이다. 이는 말초동맥 질환 중 심각한 증상으로 하지동맥의 점진적 폐쇄를 유발해 다리 조직을 괴사시켜 절단이 불가피한 경우에 이르기도 한다. 치료법으로 스텐트 삽입과 같은 혈관성형술이나 혈전 방지 약물을 사용하고 있지만, 혈관 손상이나 혈전 재발의 위험이 있어 줄기세포를 활용한 치료법 개발에 관한 관심이 높다. 한국과학기술연구원(KIST, 원장 윤석진) 생체재료연구센터 김상헌 박사 연구팀은 신소재 마이크로젤을 이용한 줄기세포의 자기조립화 플랫폼 기술을 통해 3차원 줄기세포 중증하지허혈 치료제를 개발했다고 밝혔다. 세포 친화적 신소재인 콜라겐 마이크로젤을 이용해 세포만으로 이루어진 3차원 줄기세포 치료제 대비 체내 이식이 용이하고 세포 생존율도 높였다. 줄기세포 치료제는 높은 조직 재생 능력을 지니고 있지만, 줄기세포를 단독으로 이식할 때 유발되는 손상 부위의 저산소증, 면역반응 등으로 인해 세포 생존율이 저하돼 원하는 치료 효과를 얻을 수 없게 된다. 따라서 줄기세포 치료제의 세포 생존율을 높이기 위해서는 생분해성 고분자나 세포외 기질(Extracellular Matrix)의 성분을 지지체로 사용해 줄기세포를 전달하는 소재 개발이 필요했다. 연구팀은 콜라겐 하이드로젤을 마이크로 단위의 크기로 가공해 체내 이식이 쉽고 균일한 세포분포도를 갖는 다공성의 3차원 조직체를 만들었다. 세포외 기질의 구성성분인 콜라겐은 생체적합성과 세포 활성이 우수해 마이크로젤의 입자와 줄기세포 내 콜라겐 수용체 간 상호작용을 촉진함으로써 세포의 자기조립을 유도할 수 있다. 또한, 마이크로젤 입자 사이의 간격은 3차원 조직체의 기공률을 높여 약물 전달효율과 세포 생존율을 향상한다. 연구팀이 개발한 마이크로젤-줄기세포 조직체는 세포만으로 구성된 조직체 대비 더 많은 혈관신생인자를 발현해 높은 혈관 재생 능력을 보였다. 중증하지허혈을 가진 실험용 쥐의 근육조직에 마이크로젤-줄기세포 조직체를 주입한 결과, 세포 단독 조직체 대비 혈류 흐름은 약 40% 증가했고 하지 근육 및 혈관 재생 비율은 60% 높아져 혈류량과 허혈 부위의 괴사를 예방하는 효과를 확인할 수 있었다. 이번에 개발된 줄기세포 치료제는 탁월한 혈관 신생 효과를 보여 중증하지허혈 질환으로 절단 이외에는 다른 치료 방법이 제한적이었던 환자에게 새로운 대안으로 제공될 수 있을 것으로 기대된다. 그뿐만 아니라 혈관신생은 다양한 조직 재생 과정에서 필수적인 요소이기 때문에 말초동맥질환과 유사한 기전을 가진 다른 질환으로도 확장 적용할 수 있다. KIST 김상헌 박사는 “본 연구에서 개발된 콜라겐 마이크로젤은 생체적합성이 우수해 임상 등 실용화 가능성이 매우 높은 바이오 신소재”라며 “의료현장에서 요구하는 투여 방법에 대한 기술 개발, 그리고 치료제의 명확한 작용기전 규명 및 타겟인자 발굴 등 후속 연구를 추진할 계획이다”라고 밝혔다. [그림 1] 콜라겐마이크로젤-세포 자기조립화 줄기세포 치료제의 개념 콜라겐과 히알루론산의 다이온복합체 형성 기전을 활용한 콜라겐 마이크로젤 신소재 가공 기술과 이를 이용한 마이크로젤-세포 자기조립화 줄기세포치료제의 개발을 도모하였다. 이 자기조립화 줄기세포치료제는 미세다공성 구조를 가지고 있어, 매스 트랜스퍼가 향상되고 장기간의 세포 생존이 용이해졌고, 혈관 신생인자의 발현이 향상되었다. 이러한 자기조립화 줄기세포치료제의 특성은 중증하지허혈 치료를 위한 차세대 줄기세포치료제로서 높은 잠재력을 가지고 있다. [그림 3] 마이크로젤-세포 자기조립화 줄기세포치료제의 효능 검증 생쥐 중증하지허혈 모델에서 마이크로젤-세포 자기조립화 줄기세포치료제가 대조군, 마이크로젤 단독, 마이크로젤-세포 단순혼합, 세포단독 응집체 대비 더욱 높은 혈류 흐름과 사지 보존 효과를 보여주고 있다. 마이크로젤-세포 자기조립화 줄기세포치료제의 손상된 하지에서 높은 치료 효과는 이식 부위에서의 높은 세포 생존율과 혈관 신생 촉진 등에 기인한다. 본 연구는 범부처재생의료기술개발사업단(단장 조인호)의 지원을 받아 수행됐다(22C0620L1). 이번 연구 성과는 국제학술지 ‘Bioactive Materials’ (IF 18.9, JCR 분야 상위 1.1%) 최신 호에 게재됐다. * 논문명 : A micro-fragmented collagen gel as a cell-assembling platform for critical limb ischemia repair
- 57
- 작성자생체재료연구센터
- 작성일2024.02.26
- 조회수3837
-
56
피부재생과 감각전달이 동시에 가능한 인공피부 개발
- 생체모사 바이오 인공피부와 촉각 신경전달 시스템 개발 - 센서와 생체재료가 복합화된 바이오닉 인공피부의 동물 모델 이식 성공 화상, 피부질환, 외상 등 피부 결손으로 인한 신경조직의 손상은 생명 유지 활동에 필수적인 감각인지 기능 상실을 유발하고 정신적, 신체적 고통 또한 안겨준다. 자연치유가 불가능할 정도로 손상 정도가 심각할 경우 해당 부위에 인공피부를 이식하는 수술적 치료가 필요한데, 현재까지 개발된 인공피부는 피부조직과 유사한 구조와 환경을 제공하면서 피부재생에 초점을 맞추었을 뿐 환자들의 감각을 회복시키지는 못했다. 한국과학기술연구원(KIST, 원장 윤석진)은 생체재료연구센터 정영미 박사, 스핀융합연구단 이현정 박사 연구팀이 연세대학교 유기준 교수, 성균관대학교 김태일 교수와 공동으로 인체 이식형 촉각 기능 스마트 바이오닉 인공피부를 개발했다고 밝혔다. 스마트 바이오닉 인공피부는 피부재생에 초점을 두고 있었던 기존의 인공피부와 달리 생체적합성이 높은 소재와 전자소자로 구현된 촉각 기능 전달 시스템이 융합돼 영구적으로 손상된 촉각까지도 복원할 수 있다. 연구팀이 개발한 인공피부는 피부의 주요성분인 콜라겐과 피브린(fibrin)으로 구성된 하이드로겔로 유연 압력 센서를 삽입해 외부의 미세한 압력변화도 감지할 수 있다. 감지된 압력변화는 전자 촉각 리셉터를 통해 전기 신호로 변환되고, 촉각 신경 인터페이싱 전극이 이를 신경에 전달해 피부와 동일한 촉각 기능을 수행할 수 있게 한다. 그뿐만 아니라 피부의 탄력과 조직의 결합을 담당하는 콜라겐과 피브린이 상처 주변에 있는 피부세포의 증식과 분화를 유발해 피부재생을 촉진하는 것 또한 확인했다. 스마트 바이오닉 인공피부를 심각한 피부의 손상을 입은 쥐에 이식해 피부재생 촉진 효과와 촉각 기능의 재건 효과를 실험한 결과, 이식 후 14일 경과 시점에 대조군 대비 120% 이상 상처 치료 효과를 보였다. 또한, 사람의 손끝에서 느끼는 압력 범위와 유사한 10~40kPa에서의 외부 변화를 감지하고 이에 맞는 전기 신호 조절을 통해 쥐의 반응이 달라지는 것을 확인했다. 무엇보다 연구팀이 개발한 인공피부는 손상된 피부의 피하 지방층을 따라 직접 신경에 이식하는 방식이어서 감각 전달 및 피부재생에 효과적이다. 신경이 손상된 환자의 피부재생 후에는 촉각센서가 피하 층에서 작동해 일상생활에서의 자립성을 크게 향상할 수 있다. 감각기능이 퇴화한 노년층의 경우에도 고밀도 집적 기술로 제작한 촉각 기능 전자소자를 피하에 직접 삽입하면 퇴화한 감각기능을 회복할 수 있을 것으로 기대된다. KIST 정영미 박사는 “이번 연구 성과는 생체재료와 전자소자 기술을 효과적으로 결합한 소자, 소재, 재생의학 융합연구의 결과”라며, “상용화를 위해 의료기관, 기업 등과의 협업을 통해 추가 임상실험을 진행할 예정이며, 온도, 진동, 통증 등 피부조직의 다양한 기능을 재건하는 연구로도 확장할 계획”이라고 밝혔다. 본 연구는 과학기술정보통신부(장관 이종호)의 지원으로 나노·소재원천기술개발사업(2018M3A7B4071106)을 통해 수행됐다. 이번 연구 성과는 Nature 자매지이자 국제 융합연구의 세계적 권위인 국제학술지인 ‘Nature Communications’ (IF 16.6, JCR 분야 상위 7.5%) 최신 호에 게재됐다. * 논문명 : Bionic artificial skin with a fully implantable wireless tactile sensory system for wound healing and restoring skin tactile function [그림 1] 인체 이식형 촉각 기능 스마트 바이오닉 인공피부 구성 요소 위 그림은 본 연구진의 공동연구를 통해 개발한 ‘인체 이식형 촉각 기능 스마트 바이오닉 인공피부’의 구성 요소인 바이오 인공피부, 유연 압력 센서, 전자 촉각 리셉터, 신경 인터페이싱 전극을 나타낸다. [그림 2] 통합 디바이스를 통한 외부 자극의 신경 전달 메커니즘 위 그림은 본 연구진이 개발한 통합 디바이스를 통해 외부 자극이 신경으로 전달되는 경로를 나타내는 모식도이다. ①.인공피부에 삽입되어 있는 유연 압력 센서를 통해 외부 압력이 전달되고, ②.전자 촉각 리셉터를 통해 외부 압력이 전기 신호로 변환된다. ③,④.전기 신호가 신경 인터페이싱 전극을 따라 신경에 전달된다.
- 55
- 작성자생체재료연구센터
- 작성일2024.02.19
- 조회수7045
-
54
인공지능으로 초음파 뇌질환 치료의 문턱 낮춘다
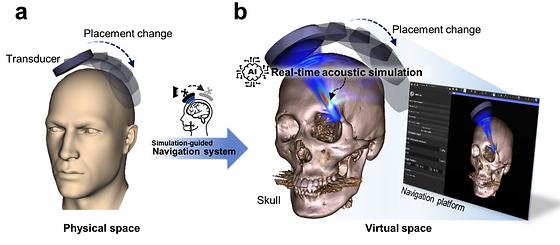
- 생성형 AI 모델을 사용한 실시간 집속초음파 시뮬레이션 기술 개발 - 집속초음파를 이용한 뇌 질환 치료의 정확성 및 안전성 향상 기대 집속초음파(Focused Ultrasound) 기술은 두개골을 열지 않고도 뇌의 안쪽 깊숙한 곳까지 수 mm의 영역에 초음파 에너지를 집중시켜 손상 부위를 치료하는 비침습적 치료 방법이다. 주변 건강한 조직에 미치는 영향을 최소화하고 합병증, 감염 등의 부작용을 줄일 수 있어 우울증, 알츠하이머병 등 다양한 난치성 뇌 질환의 치료에 적용되고 있다. 하지만 환자마다 두개골의 모양이 달라서 발생하는 초음파의 왜곡을 실시간으로 반영하기 어려워 지금까지는 활용이 제한적이었다. 한국과학기술연구원(KIST, 원장 윤석진) 바이오닉스연구센터 김형민 박사 연구팀은 생성형 AI를 기반으로 실시간 음향 시뮬레이션 기술을 개발해 집속초음파 치료 시 실시간으로 두개골에 의한 초음파 초점 위치의 왜곡을 예측 및 보정하는 데 성공했다고 밝혔다. 지금까지 비침습 집속초음파 치료 기술 분야에서 인공지능 시뮬레이션 모델의 임상 적용 가능성을 검증한 사례는 없었다. 눈에 보이지 않는 초음파 초점의 위치를 예측하기 위해 현재는 치료 전 촬영된 의료영상을 바탕으로 한 내비게이션 시스템이 활용되고 있으며, 이는 환자와 초음파 발생장치 사이의 상대적인 위치에 대한 정보를 제공한다. 그러나 두개골로 인한 초음파의 왜곡을 반영하지 못하는 한계가 있어 이를 보완하기 위해 다양한 시뮬레이션 기술이 사용되고 있지만 아직은 계산에 상당한 시간이 소요돼 실제 임상에 적용하기에 어려움이 있다. 연구팀은 의료 분야에서 이미지 생성에 널리 사용되는 딥러닝 모델인 생성적 적대 신경망(GAN) 기반의 인공지능 모델을 통해 실시간 집속초음파 시뮬레이션 기술을 개발했다. 이 기술은 초음파 음향 파동의 변화를 반영한 3차원 시뮬레이션 정보 업데이트 시간을 14초에서 0.1초로 낮추면서도 기존 시뮬레이션 기술의 오차범위인 평균 7% 이하의 최대 음압 오차와 6mm 이하의 초점 위치오차의 정확도를 보여 임상 적용의 가능성을 높였다. 연구팀은 또한 개발된 기술을 실제 의료현장에 빠르게 보급할 수 있도록 의료영상 기반 내비게이션 시스템을 개발해 성능을 검증했다. 이 시스템은 초음파 트랜스듀서(Transducer)의 위치에 따라 초당 5회 수준으로 실시간 시뮬레이션을 수행할 수 있으며, 이를 통해 집속초음파 치료 시에 두개골 내의 초음파 에너지와 초점의 위치를 실시간으로 예측하는 데 성공했다. 기존에는 긴 계산 시간으로 인하여 초음파 트랜스듀서를 미리 계획된 위치에 정확하게 위치시켜야만 시뮬레이션 결과 활용이 가능했다. 그러나 이번에 새롭게 개발된 시뮬레이션 가이드 내비게이션 시스템을 활용하면 실시간으로 얻어진 음향 시뮬레이션 결과를 바탕으로 초음파 초점을 조정하는 것이 가능해진다. 향후 집속초음파의 정확성을 높이고 치료 과정에서 발생할 수 있는 돌발상황에 신속하게 대응할 수 있어 환자에게 안전한 치료를 제공할 수 있을 것으로 기대된다. KIST 김형민 박사는 “본 연구를 통하여 집속초음파 뇌 질환 치료의 정확성과 안전성이 향상되었기 때문에 더 많은 임상 적용 사례가 나올 것”이라며 “실용화를 위해 다채널 트랜스듀서 적용 등 초음파 조사 환경을 다양화해 시스템을 검증할 계획”이라고 밝혔다. [그림 1] 시뮬레이션 가이드 내비게이션 시스템 시뮬레이션 가이드 내비게이션 시스템은 트랜스듀서의 위치에 따라 3D-cGAN 모델 사용하여 실시간 음향 시뮬레이션을 5 Hz의 속도로 실행한다. [그림 2] 3D-cGAN의 학습 예시 3D-cGAN 모델은 수치해석 방법의 결과를 정답으로 하여 학습을 진행한다. 학습 후 3D-cGAN 모델은 시뮬레이션 결과를 0.1초마다 얻을 수 있다. [그림 3] 3D-cGAN을 이용한 음향 시뮬레이션 예시 (a)3D-cGAN을 사용한 실시간 시뮬레이션 결과. (b)수치해석 방법을 사용하여 얻는 시뮬레이션 결과. (c)두 시뮬레이션 결과의 차이 [그림 4] 시뮬레이션 가이드 내비게이션에 대한 임상적용 예시 실시간 시뮬레이션 결과를 토대로 원하는 부위에 정확하게 타겟팅 되었을 때에만 하드웨어를 제어하여 초음파를 조사할 수 있다. ○ 논문명: Real-Time Acoustic Simulation Framework for tFUS: A Feasibility Study Using Navigation System ○ 학술지: NeuroImage ○ 게재일: 2023.10.14.(온라인) ○ DOI: https://doi.org/10.1016/j.neuroimage.2023.120411 ○ 논문저자 - 박태영 학생연구원(제1저자/KIST 바이오닉스연구센터) - 김형민 책임연구원(교신저자/KIST 바이오닉스연구센터)
- 53
- 작성자바이오닉스연구센터 김형민 박사팀
- 작성일2023.11.23
- 조회수11563
-
52
돌연사 원인 1위 심근경색, 면역반응 조절로 치료한다.
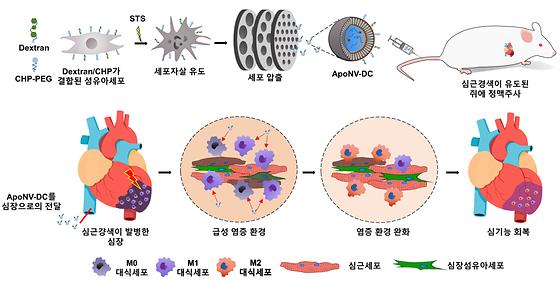
- 심근경색 부위 염증 완화와 이에 따른 심장 기능 개선 효과 검증 - 사멸세포 유래 나노소포체로 면역반응을 조절하는 새로운 치료법 제시 우리나라 성인 돌연사 원인 1위이자 사망원인 2위 질환인 심근경색은 초기 사망률이 30%이며, 의료기관에 후송돼 치료하는 경우에도 5~10% 정도가 사망하는 치명적인 질환이다. 2017년 99,647명에서 2021년 126,342명으로 5년 새 26.8% 늘어나는 등 국내 심근경색 환자 수는 가파른 증가추세를 보이고 있는데, 지금까지 약물요법, 경피적 동맥성형술과 동맥우회술이 치료법으로 알려져 있으나, 이에 반응하지 않는 중증에는 적용이 어려웠다. 한국과학기술연구원(KIST, 원장 윤석진) 생체재료연구센터 정윤기 책임연구원과 이주로 박사 연구팀은 가톨릭대학교 의과대학 박훈준 교수, 박봉우 박사와 함께 세포사멸이 유도된 섬유아세포로부터 유래된 나노소포체를 활용해 면역반응을 조절하는 방식의 새로운 심근경색 치료법을 개발했다고 밝혔다. 심근경색은 심장에 혈액을 공급해 주는 혈관인 관상동맥이 좁아지거나 막히게 돼 심장근육에 충분한 혈액 공급이 이루어지지 못하게 되고, 이에 따라 심근에 영양 및 산소 결핍이 생겨 심장 기능 부진을 일으키는 허혈성 심장질환이다. 시장조사기관인 테크나비오(Technavio)에 따르면 전세계 심근경색 치료제 시장 규모는 2026년까지 연평균 4.7%의 성장률을 기록하며 20억 2,000만 달러에 이를 것으로 전망된다. 최근에는 엑소좀(exosome) 등의 줄기세포 유래 나노소포체(nanovesicles)를 이용해 염증반응을 조절하는 심근경색 치료제 연구가 수행되고 있으나, 줄기세포는 대량생산이 어려워 치료제의 경제성을 확보하는 데 한계가 있었다. 연구팀은 세포 내 생화학적 변화에 의해 자살하는 사멸세포(Apoptotic Cell)를 원료로 하는 나노의약품을 통해 심장근육의 염증반응을 감소시킴으로써 중증 심근경색 치료의 가능성을 확인했다. 이러한 반응은 허혈성 심근경색 질환 부위에 특이적인 펩타이드와 대식세포 섭식에 특이적인 물질을 섬유아세포 표면에 부착함으로써 가능했는데, 이를 위해 연구팀은 표면이 개량된 섬유아세포의 세포사멸을 유도하여 항염증적인 특성을 가지면서도 심근경색 부위에 있는 대식세포에 특이적으로 전달될 수 있는 나노소포체를 개발했다. 동물실험에서는 쥐에게 정맥주사된 나노소포체가 심근경색 부위로 효과적으로 전달되고, 대식세포에만 특이적으로 다량 유입된 것을 확인했다. 그 결과, 좌심실의 수축력을 나타내는 지표인 '좌심실 박출률(LVEF)'이 4주 동안 대조군에 비해서 1.5배 이상 증가하여 심박출량 개선 효과가 있음을 확인했다. 또한, 심근경색 부위에서 염증 완화 효과와 함께 심근경색 부위의 섬유화를 감소시키고 심장 내 혈관 보존율과 심근세포의 생존율이 높아지는 등 심장 기능이 향상됐다. KIST 정윤기 박사는 “세포자살이 유도된 세포로부터 생산한 나노소포체를 이용해 심근경색 질환 치료에 적용한 최초 연구이며, 줄기세포가 아닌 일반 세포를 이용하기 때문에 대량생산이 가능한 장점을 갖고 있다”라며, “향후 가톨릭대 의과대학, 바이오기업과 공동연구를 통해 임상시험 등 치료의 유효성과 안전성 검증 연구를 진행할 계획"이라고 밝혔다. 본 연구는 과학기술정보통신부(장관 이종호) 지원으로 한국연구재단 나노 및 소재기술개발사업(2021M3H4A1A04092878)과 세종과학펠로우십사업(2021R1C1C2010587)의 지원을 통해 수행되었으며, 연구 결과는 재료 분야 국제학술지 ‘Advanced Functional Materials’ (IF:19.0, JCR 분야 상위 4.7%) 6월호에 게재됐다. * Targeted Delivery of Apoptotic Cell-Derived Nanovesicles prevents Cardiac Remodeling and Attenuates Cardiac Function Exacerbation [그림 1] ApoNV-DC의 제작 과정과 이의 심근경색 치료 메커니즘 [그림 2] 심근경색 부위에서 ApoNV의 항섬유화 효과 [그림 3] ApoNV-DC의 정맥주사 4주 이후 심기능 향상 효과. 심장 비대 감소 및 심박출량 등의 심기능 지표 향상 ○ 논문명: Targeted Delivery of Apoptotic Cell-Derived Nanovesicles prevents Cardiac Remodeling and Attenuates Cardiac Function Exacerbation ○ 학술지:Advanced Functional Materials ○ 게재일: 2023.06.02. ○ DOI: https://doi.org/10.1002/adfm.202210864 ○ 논문저자 - 이주로 박사후연구원(제1저자/하버드 의과대학), - 박훈준 교수(제1저자/카톨릭대학교 의과대학) - 정윤기 책임연구원(교신저자/KIST 생체재료연구센터) - 박봉우 박사(교신저자/카톨릭대학교 의과대학)
- 51
- 작성자생체재료연구센터 정윤기 박사팀
- 작성일2023.08.07
- 조회수4615
-
50
인공장기 인쇄하는 안전한 바이오 잉크
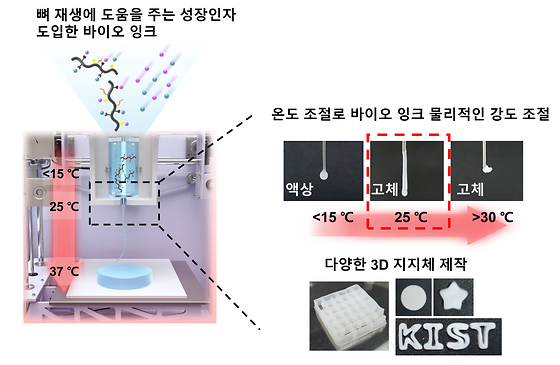
- 광경화 과정 없이 조직 재생을 유도하는 3D 바이오 프린팅 잉크 개발 - 인공장기 등 환자 맞춤형 재생 치료기술로 응용 기대 초고령화 사회로의 진입과 더불어 사고로 인한 부상, 만성질환의 증가 등으로 인공장기나 조직과 같은 생체재료 개발이 활발하다. 최근에는 세포와 생체재료를 사용해 3차원의 인공조직 구조를 구현하는 3D 바이오 프린팅 기술이 크게 주목받고 있다. 그런데, 바이오 잉크로 가장 많이 사용되는 하이드로겔의 경우 광경화 과정에서 사용되는 화학적 가교제와 자외선으로 인해 체내에서 세포 독성을 일으킬 수 있다는 문제가 있었다. 한국과학기술연구원(KIST, 원장 윤석진) 생체 재료 연구단 송수창 박사 연구팀은 광경화 과정 없이 온도 조절 만으로 물리적인 구조를 안정적으로 유지하고, 조직 재생을 유도한 후 일정 시간이 지나면 체내에서 생 분해되는 폴리포스파젠 하이드로겔 기반의 온도 감응성 바이오 잉크를 최초로 개발했다고 밝혔다. 기존의 하이드로겔 기반 바이오 잉크는 출력 후 3차원 지지체의 물리적 강도를 강화하기 위해 사용되는 광경화 과정을 반드시 거쳐야 하고, 조직 재생 효과를 증대 시키기 위해 외부 배양 세포를 이식함으로써 인체 내 부작용의 위험성이 컸다. 이에 연구팀은 저온에서는 액상 형태로 존재하고 체온에서는 단단한 젤로 변화하는 특성을 지닌 온도 감응성 폴리포스파젠 하이드로겔을 이용해 새로운 바이오 잉크 소재를 개발했다. 이를 통해 화학적 가교제나 자외선 조사 과정 없이 온도 조절 만으로 조직 재생이 가능하며 물리적으로 안정적 구조를 가진 3차원 지지체를 제작해 인체의 면역 부작용 발생 가능성을 최소화할 수 있게 되었다. 개발된 바이오 잉크는 또한 조직 재생에 도움을 주는 단백질인 성장 인자와 상호작용 할 수 있는 분자 구조로 되어 있어 세포의 성장 및 분화, 면역 반응 등을 조절하는 성장 인자를 장기간 보존할 수 있다. 연구팀은 바이오 잉크를 통해 출력된 3차원 지지체 내에 세포의 분화를 자율적으로 조절할 수 있는 환경을 유도함으로써 조직 재생 효과를 극대화할 수 있었다. 연구팀은 세포 유입과 뼈 재생에 필요한 전환 성장 인자 베타 1((Transforming growth factor beta 1, TGF-β1)과 골 형성 단백질(Bone morphogenetic protein-2, BMP-2)을 포함한 바이오 잉크를 3D 바이오 프린터로 출력해 3차원 지지체를 제작한 뒤 쥐의 뼈 손상 부위에 이식하는 실험을 수행했다. 그 결과 주변 조직으로부터 세포가 지지체 안으로 유입되어 뼈가 정상 조직 수준으로 재생되었으며, 이식된 3차원 지지체는 체내에서 42일에 걸쳐 서서히 생 분해되는 것을 확인할 수 있었다. KIST 송수창 박사는 “연구팀은 지난 2022년 6월 온도 감응성 폴리포스파젠 하이드로겔을 ㈜넥스젤바이오텍에 기술 이전해 골이식재, 성형필러 등의 제품 개발을 진행하고 있다."며, "이번에 개발된 바이오 잉크는 그 자체의 물리적 특성을 달리해 뼈 조직 외에 다른 조직의 재생에도 적용하는 후속 연구를 진행 중이며, 최종적으로는 부위 별 조직 및 장기 맞춤형 바이오 잉크를 제품화할 수 있을 것으로 기대한다."라고 밝혔다. 본 연구는 과학기술정보통신부(장관 이종호) 지원을 받아 KIST 주요 사업으로 수행되었으며, 연구 결과는 재료 분야 국제 학술지인 'Small'(IF : 15.153, JCR 분야 상위 7.101%) 최신 호에 표지 논문(Inside back cover)으로 게재되었다. [그림 1] 온도에 따른 성장인자를 포함한 바이오 잉크의 물리적인 강도 변화 및 3차원 지지체 프린팅 [사진 1] KIST 연구진이 개발한 온도감응형 하이드로겔 기반의 새로운 바이오잉크(가운데)와 이를 이용하여 3D바이오 프린팅 기술로 제작된 3차원 지지체(좌, 우) [그림 2] 바이오 잉크로 3D 프린트한 지지체를 뼈 손상 부위에 이식 후 생분해와 뼈 재생효과 확인 [사진 2] KIST 김준 위촉연구원(제1저자)가 3D 바이오 프린터로 출력한 조직재생용 3차원 지지체를 살펴보고 있다 [사진 3] 이번 기술을 개발한 KIST 연구진.((좌측, 제1저자) KIST 김준 위촉연구원, (우측, 교신저자)KIST 송수창 책임연구원) [그림 3] 표지논문(Inside back cover) 선정 이미지 ○ 논문명: Thermo-Responsive Nanocomposite Bioink with Growth-Factor Holding and its Application to Bone Regeneration ○ 게재일: 2022.12.26. ○ DOI: https://doi.org/10.1002/smll.202203464 ○ 논문저자 - 김준 위촉연구원(제1저자/KIST 생체분자인식연구센터) - 정훈기 책임연구원(제1저자/KIST 생체분자인식연구센터)
- 49
- 작성자생체재료연구센터 송수창 박사팀
- 작성일2023.04.03
- 조회수10829
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 다음 페이지로 이동하기
- 마지막 페이지로 이동하기

![[그림 1] 폴리아민 생합성 억제를 통한 BRAF 억제 항암제 내성 극복](/app/board/attach/image/thumb_14093_1726039438000.do)
![[그림 1] 비흡연폐암 유전단백체 분석 연구의 개요](/app/board/attach/image/thumb_13853_1715556530000.do)
![[그림 1] DNA 오리가미 기반의 백신 작용 원리](/app/board/attach/image/thumb_13840_1714608760000.do)
![[그림 2] 그림 1의 웨어러블 소자를 아이에게 부착하여 테스트하는 모습](/app/board/attach/image/thumb_13816_1713918964000.do)
![[그림 1] 다감각 VR을 통한 통제된 자기 환각 유도와 이에 따른 격자 세포 활성 관찰](/app/board/attach/image/thumb_13806_1713145802000.do)
![[그림 2] 통합 디바이스를 통한 외부 자극의 신경 전달 메커니즘](/app/board/attach/image/thumb_13682_1708302038000.do)