연구본부소개
-
48
부작용은 줄이고 치료 효과는 높인 항암 면역 치료제
- 환자의 면역 능력을 높이는 데 도움을 주는 항암 약물 개발 - 암세포에서 활성화되어 부작용이 없는 무독성 면역 치료제 개발 기대 암세포를 직접 공격하여 죽이는 기존의 암 치료법과는 달리, 몸속의 면역력을 강화해 암세포를 죽이는 항암 면역치료는 최근 들어 주목받고 있는 새로운 방식의 암 치료법이다. 하지만 기본 면역능력이 좋은 20% 정도의 환자에게서만 효과를 기대할 수 있어 대다수의 환자에게 적용할 수는 없는 현실이다. 병원에서 암세포 치료 약물로 사용되고 있는 '독소루비신’은 최근 항암 효과 외에도 암세포가 죽으면서 방출되는 다양한 성분들로 인해 환자의 면역력이 높아질 수 있음이 알려졌다. 하지만, 독소루비신은 암세포 외에 정상 세포에도 독성과 염증반응을 일으킬 수 있고 특히, 면역세포에도 독성을 보여 환자의 면역수준을 오히려 떨어트릴 수 있는 문제가 있어 아직 항암 면역 치료용으로 사용하는데 많은 한계를 가지고 있다. 한국과학기술연구원(KIST, 원장 윤석진)은 테라그노시스연구센터 류주희 박사 연구팀이 면역세포를 포함한 정상 세포에 미치는 독성은 최소화하면서 암세포에만 반응하여 암세포를 죽이고, 환자의 면역상태를 높여 항암 면역치료에 도움을 줄 수 있는 항암 전구체 약물을 개발했다고 밝혔다. KIST 테라그노시스연구센터는 `20년, 독소루비신 항암제의 내성을 억제하고 정상 세포와는 반응하지 않게 하여 암세포만 죽일 수 있는 항암치료제를 개발한 바 있다. 독소루비신이 암세포를 죽이는 항암능력에 대한 지난 연구와는 달리 연구팀은 독소루비신이 환자의 면역능력을 향상시킬 수 있다는 점에 집중하여 연구한 결과 항암 면역 치료용으로 활용할 수 있는 약물을 개발하였다. 개발한 약물은 독소루비신을 비활성화 시키는 펩타이드와 결합되어 약효나 독성을 나타내지 않는 상태로 있다가, 암세포에 다량 존재하는 효소에 의해 활성화되어 항암효능을 나타내게 된다. 따라서 정상 세포에서는 활성화되지 않아 독성 및 염증반응은 일어나지 않고 암세포에서는 활성화되어 독소루비신의 성분으로 인해 암세포를 죽이고, 환자의 면역 능력을 높여주므로 향후 활발한 항암 면역반응을 유도한다. 그 결과 개발된 항암 약물은 비임상 동물모델에서 항암 면역반응성을 크게 향상시켰고 정상조직에서의 부작용인 염증반응 및 독성이 크게 감소하였다. 향후 항암치료 효과를 높이기 위해 해당 약물을 부작용 걱정 없이 더 높은 농도로 처리할 수 있을 것으로 보인다. 또한, 기존 임상에서 사용되고 있는 약물을 활용하여 개발한 약물이므로 임상시험이 비교적 단순하여 상용화 절차가 간단하며, 4개의 아미노산과 독소루비신이 결합한 간단한 화학구조로 인해 제조공정이 단순하여 대량 생산이 용이하다. 따라서 약물의 임상 및 사업화를 고려한 약물의 제조 면에서 큰 이점을 가지고 있다. KIST 류주희 박사는 “면역 치료제의 놀라운 치료 효과를 대다수 환자가 누리기 위해서는 적절한 환자들의 면역수준이 올라와야 하는데, 정상조직에서의 독성 및 염증반응을 줄이면서 약물의 항암 면역반응을 유지할 수 있는 항암 전구체 약물이 큰 기여를 할 수 있을 것”이라고 밝혔다. 본 연구는 과학기술정보통신부(장관 최기영) 지원으로 KIST 주요사업 및 한국연구재단 중견연구자지원사업으로 수행되었으며, 연구결과는 재료 및 바이오소재 분야의 국제학술지 ‘Biomaterials’ (IF:10.317, JCR 분야 상위 2.6%) 최신 호에 게재되었다. * (논문명) Cancer-antivated doxorubicin prodrug nanoparticles induce preferential immune response with minimal doxorubicin-related toxicity - (제 1저자) 한국과학기술연구원 양수아 학생연구원 - (제 1저자) 한국과학기술연구원 심만규 위촉연구원 - (교신저자) 한국과학기술연구원 김광명 책임연구원 - (교신저자) 한국과학기술연구원 류주희 선임연구원 <그림설명> [그림 1] 암세포 특이적 항암 전구체 약물의 면역반응 유도 모식도 항암 전구체 약물은 EPR(Enhanced Permeability and Retention) 효과에 의해 종양 조직에 축적되며 암세포에서 과발현되는 카텝신B 효소에 의해 특이적으로 활성화되어 독소루비신을 방출한다. 종양 조직 내에서 종양 특이적으로 면역원성 세포사멸을 일으키며 면역세포에 대한 독성을 최소화하여 종양 조직 내 T 세포 등의 효과적인 성숙 및 활성화를 이룬다. 이와 동시에 정상 기관의 전신 독성 및 염증 반응을 현저히 감소시킨다.
- 47
- 작성자테라그노시스연구센터 류주희 박사팀
- 작성일2021.05.02
- 조회수10708
-
46
부작용 치료하는 신개념 스텐트 나온다
- 세포로 덮인 인체삽입용 소재 제조 신기술 개발 - 체내 삽입형 의료기기에 치료세포 탑재, 치료 효과 증대 및 부작용 억제 막힌 혈관을 확장하는 스텐트, 치아나 뼈를 대체하는 임플란트 등 체내에 삽입하는 의료소재는 재생의학 분야에서 수십 년간 활용되고 있다. 하지만 염증반응이 생기거나 소재 주변이 섬유조직으로 둘러싸이기도 하고 혈전을 유발시켜 혈관을 막기도 하는 등 심각한 부작용과 기능 상실로 인해 장기적인 활용이 어렵다. 최근 국내 연구진이 의료소재 표면에 세포주변물질을 쌓아 부작용을 줄이는 기술을 개발해 주목받고 있다. 한국과학기술연구원(KIST, 원장 윤석진)은 생체재료연구센터 정윤기 박사 연구팀이 차의과학대학교(총장 김동익) 한동근 교수 연구팀과의 공동연구를 통해 체내 삽입형 의료소재 표면에 세포의 주변을 구성하는 물질을 쌓은 소재를 개발했다고 밝혔다. 해당 소재에는 줄기세포 등의 치료 기능을 가진 세포를 탑재할 수 있어, 세포치료제를 원하는 부위에 전달하는 데 활용할 수 있다. 연구진은 소재의 표면 및 생체물질과 강한 결합이 가능한 화합물(폴리도파민)과 단백질(피브로넥틴)을 코팅하고 그 위에 세포를 배양했다. 배양된 세포는 세포 주변환경 구성물질(세포외기질)을 만들게 되는데, 이후 세포만 제거하고 세포외기질은 남겨 의료목적으로 필요한 세포를 부착할 수 있는 공간을 만든 소재를 개발했다. 세포외기질은 세포와 친화력이 높아 체내의 어떤 환경에서도 세포의 부착과 생존을 가능하게 해 필요한 세포를 치료 부위에 전달할 수 있으며 의료소재와 신체조직간의 부작용을 최소화할 수 있었다. 연구진은 막힌 혈관을 확장하는 시술에 활용하는 의료기기인 스텐트 표면에 개발한 소재를 적용했다. 스텐트는 물리적으로 혈관을 늘이기 때문에 시술부위 주변에 상처가 생겨 염증이나 혈전으로 인해 다시 혈관이 막혀버리는 부작용의 위험성을 갖고 있다. 개발한 소재를 통해 혈관을 재생할 수 있는 혈관전구세포를 함께 실어서 시술한 결과 혈관 확장 효능이 뛰어날 뿐만 아니라 손상된 혈관 내벽이 재생되어 부작용인 신생내막 형성률을 70% 이상 경감시킬 수 있었다. KIST 정윤기 박사는 “본 기술은 인체 내에 삽입하는 다양한 소재에 적용 가능해 스텐트와 같은 의료기기뿐만 아니라 장기간 이식이 필요한 이식용 임플란트와 더불어 미래 기술로 주목하고 있는 체내삽입형 진단 및 치료 기기 분야에 범용적인 플랫폼 원천기술로 활용될 것으로 기대된다.”라고 밝혔다. 본 연구는 과학기술정보통신부(장관 최기영) 지원을 받아 KIST 주요사업 및 한국연구재단 바이오의료기술개발사업, 중견연구자지원사업, 범부처전주기의료기기연구개발사업으로 수행되었으며, 연구결과는 재료과학 분야의 국제학술지 ‘Advanced Functional Materials’ (IF:16.836, JCR 분야 상위 3.98%) 최신 호에 게재되었다. * (논문명) Robustly supported extracellular matrix improves the intravascular delivery efficacy of endothelial progenitor cells - (제 1저자) 한국과학기술연구원 박충원 학생연구원(現, 홍콩과기대) - (제 1저자) 한국과학기술연구원 박광숙 Post-Doc(現, 연세의대) - (교신저자) 차의과학대학교 한동근 특훈교수 - (교신저자) 한국과학기술연구원 정윤기 책임연구원 <그림설명> [그림 1] 세포외기질이 강하게 결합된 소재 구조 모식도 금속 표면에 고정된 폴리도파민에 의해 피브로넥틴이 균일하고 견고하게 코팅되고 피브로넥틴의 콜라겐 및 당단백질 결합 부위를 통해 세포 유래 세포외기질이 강하게 결합된 표면을 제조할 수 있다. [그림 2] 세포외기질 결합 소재와 그 위에 세포가 탑재된 현미경 사진 금속 표면에 실제로 코팅된 세포외기질을 관찰하면 얇은 막으로 코팅이 되어 있으나 미세하게 관찰해 보면 3차원 네트워크 형태를 띠고 있음. 또한 세포외기질이 코팅된 스텐트에 세포를 배양하여 부착시키면 많은 세포(왼쪽, 가운데 그림의 점 모양)가 안정적(우측 그림의 붉은색 구조)으로 부착되어 있는 것을 볼 수 있다. [그림 3] 토끼 혈관에 3일간 이식 후 제거한 시편
- 45
- 작성자생체재료연구센터 정윤기 박사팀
- 작성일2021.04.29
- 조회수8673
-
44
인공 장기, 피부 등 생체조직 더욱 쉽게 만든다
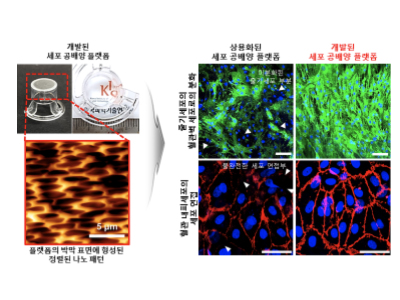
- 두 가지 이상의 세포를 나노패턴 정렬, 원하는 세포로 배양하는 플랫폼 개발 - 동물을 이용한 전임상 시험, 인공 장기로 대체하여 신약개발 프로세스 단축가능 국내 연구진이 특별한 전처리 없이도 줄기세포를 혈관 벽 세포, 골세포 등 원하는 형태의 세포로 분화시킬 수 있고, 전임상 시험을 위한 인공 장기 혹은 인공 피부, 심장 패치 등의 이식용 인공조직 제작에 활용할 수 있을 것으로 기대되는 기술을 개발하여 화제다. 한국과학기술연구원(KIST, 원장 윤석진)은 생체재료연구센터 정영미 박사 연구팀이 두 가지 이상의 세포를 한 번에 배양하여 우리 몸의 생체조직과 유사한 조직을 형성시킬 수 있는 새로운 다공성 박막 기반 세포 공배양(共培養) 플랫폼을 개발했다고 밝혔다. 신약 개발에 필요한 동물을 이용하는 전임상 시험을 대체하기 위해 인공 장기 등을 제작하는 방법 중 하나로 서로 다른 종류의 세포들을 함께 키우는 ‘세포 공배양법’이 있다. 우리 몸은 다양한 종류의 세포들로 구성되어있기 때문에 우리 몸의 생체조직을 보다 비슷하게 모사하기 위해서는 이러한 ‘세포 공배양법’이 필수적이며 실제 생체조직을 모사하기 위한 거의 모든 연구에서 이용되고 있는 방법 중 하나이다. 하지만 서로 다른 세포들을 단순히 섞어서 함께 키우면 성장이 빠른 세포에 의해 다른 세포들이 잠식되어 정상적으로 자랄 수 없게 되는 경우가 많다. 이러한 문제를 해결하기 위한 다양한 세포 배양 플랫폼 가운데 다공성 막을 사용하는 세포 공배양 플랫폼은 막의 두께가 비교적 두껍고, 막에 있는 구멍들의 밀집도가 낮아 세포 사이의 활발한 상호작용을 유도하지 못한다는 한계가 있었다. 또한 실제 세포가 자라는 체내 환경과는 다른 환경이 조성되기 때문에 이를 보완하기 위한 부수적인 처리가 필요했다. KIST 연구진은 이러한 한계점을 극복하고 기존의 막 보다 1/10 정도로 얇은 두께를 갖고, 구멍들의 밀집도를 높여 세포 간의 상호작용을 향상시킨 플랫폼을 개발했다. 개발한 공배양 플랫폼은 부드럽고 탄성이 있는 고분자 소재를 이용하고 박막의 신축성을 조절하여 세포외기질과 비슷한 표면 특성을 갖도록 하여 체내 환경과 유사한 환경을 세포들에게 제공해 줄 수 있다. 또한 혈관, 근육, 심장 등 우리 몸을 구성하는 조직들은 세포들이 특정 방향으로 정렬되어 있는 경우가 많은데 KIST 연구진이 개발한 플랫폼은 별도의 처리 없이도 박막의 신축성을 이용하여 기공이 정렬되고 나노 패턴이 형성되어 세포를 정렬시킬 수 있어서 생체조직을 배양하는 데 장점이 있다. 이 플랫폼을 이용하여 사람의 혈관 안쪽 면을 구성하는 혈관 내피세포와 혈관 벽을 구성하는 세포로 분화될 수 있는 줄기세포를 공배양한 결과, 상용화된 플랫폼에 비해 줄기세포가 혈관 벽 세포로 약 2.5배가량 더 많이 분화되었으며 혈관 내피세포들은 효과적으로 세포연접을 형성하여 우수한 혈관 장벽 기능을 보여주었다. KIST 정영미 박사는 “본 세포 공배양 플랫폼은 현재 상용화된 플랫폼에 비해 간단하면서도 효율적으로 세포를 배양할 수 있어서 제약회사, 병원 등 생물학적 평가가 요구되는 다양한 분야에서 동물실험을 대체할 수 있는 전임상 시험용 툴로 적용될 수 있어 효용 가능성이 클 것이라 기대된다.”라고 밝혔다. 본 연구는 과학기술정보통신부(장관 최기영) 지원으로 한국연구재단 나노·소재기술개발사업으로 수행되었으며, 연구 결과는 기능성 재료 분야 국제 저널인 ‘Advanced Functional Materials’ (IF: 16.836, JCR 분야 상위 3.981%) 최신 호에 게재되었다. * (논문명) Use of Elastic, Porous, and Ultrathin Co-Culture Membranes to Control the Endothelial Barrier Function via Cell Alignment - (제 1저자) 한국과학기술연구원 류진 박사후연구원(現, Purdue University 박사후연구원) - (제 1저자) 한국과학기술연구원 김태희 박사후연구원 - (교신저자) 한국과학기술연구원 정영미 책임연구원 <그림설명> [그림 1] 고탄성 생체적합성 고분자를 이용하여 정렬된 나노 패턴을 갖는 세포 공배양 플랫폼 제작과정을 보여주는 모식도 [그림 2] 개발된 세포 공배양 플랫폼에서 줄기세포의 분화 효율과 혈관벽 기능에 중요한 세포연접 형성 정도를 보여주는 결과
- 43
- 작성자생체재료연구센터 정영미 박사팀
- 작성일2021.01.27
- 조회수11750
-
42
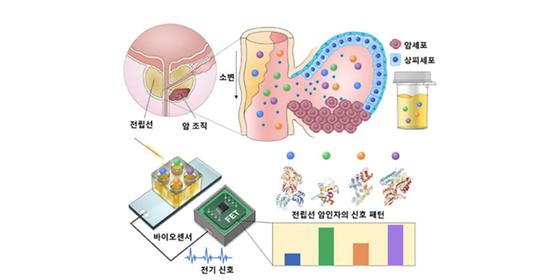
인공지능으로 소변검사를 통한 암 진단 정확도 높여
- 전립선암의 여러 인자를 인공지능으로 분석해 암의 고정밀 진단 성공 - 소변을 활용한 다른 암 종의 정밀 진단에 활용 가능 전립선암은 남성 암 중 가장 많이 발생하는 암 중 하나이다. 기존에는 혈액검사를 통해 일차적인 전립선암 여부를 판별하고 있다. 하지만 진단의 정확도가 30%에 불과해 많은 환자들이 혈액검사 후 침습적인 조직검사를 받아야 하고, 그에 따른 출혈과 고통 등의 부작용을 겪고 있다. 한국과학기술연구원(KIST, 원장 윤석진)은 생체재료연구센터 이관희 박사팀이 서울아산병원 정인갑 교수 연구팀과의 공동연구를 통해 소변에서 전립선암을 단 20분 만에 100%에 가까운 정확도로 진단하는 기술을 개발했다고 밝혔다. 연구팀은 초고감도 전기신호 기반 바이오센서에 스마트 인공지능 분석법을 도입해 기술 개발에 성공했다. 소변을 활용한 진단검사는 환자 편의성이 뛰어나고 침습적인 조직검사가 필요하지 않아 부작용이나 환자의 고통 없이 암을 진단 할 수 있다. 하지만 소변에는 암 인자의 농도가 낮기 때문에 소변 기반의 바이오센서는 그동안 정밀진단보다는 위험군을 분류하는 데 활용되어 왔다. KIST 이관희 박사팀은 그동안 전기신호 기반의 초고감도 바이오센서를 활용하여 소변에서 질병을 진단하는 기술을 개발해왔다. 암 진단과 관련해 단일한 암 인자로는 진단 정확도를 90% 이상으로 끌어올리는 데는 한계가 있었다. 연구진은 이 문제를 극복하기 위해 한 종류의 암 인자가 아닌 서로 다른 여러 종의 암 인자를 동시에 활용해 진단 정확도를 획기적으로 높이는 데 성공했다. 연구진은 전립선암 진단을 위해 기존의 ‘전립선 특이항원(PSA)’ 기반 검출의 문제점을 개선하기 위해 소변에서 극미량의 네 가지 암 인자들을 동시에 측정할 수 있는 초고감도 반도체 센서 시스템을 개발했다(그림3). 이 센서를 통해 얻은 네 가지 암 인자와 전립선암 사이의 상관관계를 인공지능에게 기계학습 시키고, 얻어진 검출 신호들의 복잡한 패턴에 따라 암 여부를 진단할 수 있는 알고리즘을 개발해냈다. 이 인공지능 분석법을 활용하여 전립선암을 진단한 결과, 76개의 소변 표본에서 전립선암 환자를 95.5%로 진단했다. 연구진은 향후 임상을 확대하여 더욱 많은 환자 정보를 학습시켜 진단 알고리즘의 정확성을 높일 계획이라고 밝혔다. KIST와 공동 연구를 진행한 서울아산병원 정인갑 교수는 “수술이나 치료가 필요한 환자를 소변을 활용해 높은 정확도로 선별함으로써 불필요한 조직검사와 치료를 최소화하여 의료비 및 의료진의 피로도를 획기적으로 줄일 수 있다.”라고 말했다. 한편, KIST 이관희 박사는 “소변만으로 100%에 가깝게 전립선암을 신속히 진단할 수 있는 스마트 바이오센서의 개발은 소변을 활용한 다른 암 종의 정밀 진단에 활용될 수 있을 것”이라고 전망했다. 본 성과는 과학기술정보통신부(장관 최기영) 지원으로 한국연구재단 중견연구자지원사업, 범부처(과학기술정보통신부, 산업통상자원부, 보건복지부, 식품의약품안전처) 전주기의료기기연구개발사업단의 지원을 받아 수행되었으며, 연구 결과는 나노분야 권위지인 ‘ACS Nano’(IF: 14.588, JCR 분야 상위 5.255%) 최신 호에 게재되었다. * (논문명) Noninvasive Precision Screening of Prostate Cancer by Urinary Multimarker Sensor and Artificial Intelligence Analysis - (제 1저자) 한국과학기술연구원 김호준 선임연구원 - (제 1저자) 한국과학기술연구원 박성욱 박사후연구원 - (제 1저자) 서울아산병원 정인갑 교수 - (교신저자) 한국과학기술연구원 이관희 책임연구원 <그림설명> [그림 1] 반도체 기반의 초고감도 바이오센서를 활용하여 환자 소변에서 극미량의 암인자들을 검출하고, 여기서 발생하는 검출 신호의 패턴을 얻어냄 [그림 2] 암인자들의 복잡한 신호 패턴을 다수 확보하여 인공지능 분석법을 활용해 암과 정상을 100% 가까운 수치로 정밀 진단하는 데 성공함 [그림 3] 연구진이 개발한 초 고감도 바이오 센서 실물 사진
- 41
- 작성자생체재료연구센터 이관희 박사팀
- 작성일2020.12.24
- 조회수11040
-
40
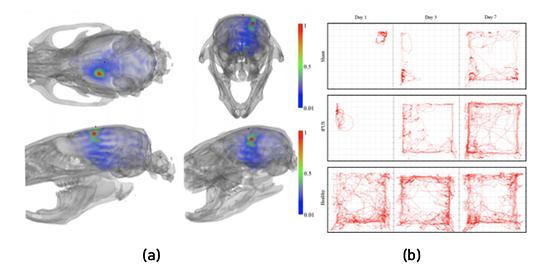
착용형 무선 초음파 기기로 수술 없이 뇌졸중 치료
- 착용 가능한 소형 무선 초음파 뇌 자극기로 뇌졸중 재활 효능 전임상 검증 - 일상생활에서 사용하는 착용형 초음파 자극 기술 개발 발판 마련 뇌졸중은 사망률이 높고, 사망하지 않더라도 뇌에 혈액이 공급되지 않아 신경세포가 손상되면 신체를 움직이기 어려워지는 심각한 질병이다. 뇌졸중으로 손상된 뇌신경 재활을 위해 운동 요법과 뇌신경 자극 등 다양한 기술이 개발되고 있다. 그중 저강도 집속초음파 자극 기술은 수술 없이 초음파가 두개골을 통과하여 원하는 위치에 높은 정확도로 기계적인 에너지를 전달하여 신경세포를 활성 혹은 억제할 수 있어 뇌졸중 등의 신경 손상 질환의 재활 치료기술로 기대되고 있다. 한국과학기술연구원(KIST, 원장 윤석진)은 바이오닉스연구센터 김형민 박사팀이 착용이 가능한 무선 저강도 집속초음파 뇌 자극기를 제작하여 뇌졸중 동물 모델에 적용, 뇌졸중으로 손상된 뇌신경의 무선 재활 치료기술을 개발했다고 밝혔다. 연구진은 2018년 소뇌 심부에 저강도 집속초음파 자극을 가하여 편마비에 의해 저하된 운동기능이 회복되는 치료법을 밝힌 바 있으며(Neurorehabil Neural Repair. 2018 Sep;32(9):777-787.), 2020년에는 뇌졸중 소뇌 심부 저강도 집속초음파 자극 치료기술이 뇌파 중 하나인 델타파의 변화와 밀접하게 연관됨을 입증하였다.(IEEE Transactions on Neural Systems and Rehabilitation Engineering, 2020, 28(9): 2073-2079.) 이 기술을 다양한 환경에서 뇌졸중 환자의 재활 치료에 효율적으로 사용하기 위해서는 초음파 기계를 일상생활에서 편하게 착용할 수 있어야 하지만, 기존 초음파 뇌 자극기는 무겁고, 고정되어있어 마취되거나 고정된 동물을 대상으로 하는 실험에서만 사용할 수 있어 실용화가 어려웠다. KIST 연구진은 축적된 연구 결과를 바탕으로 저강도 집속초음파를 무선으로 조정할 수 있는 약 20g의 가벼운 착용형 뇌 자극기를 개발하여 뇌졸중 쥐 모델에 사용해 운동 능력을 측정한 결과, 재활 효능이 있다는 것을 검증하였다. 뇌졸중 쥐 모델의 뇌에서 운동을 관장하는 영역에 약 426kPa의 압력을 갖는 초음파를 가하여 재활 3일 후 초음파를 가하지 않은 뇌졸중 모델과 비교했을 때 운동 능력이 유의미하게 향상되었고, 재활 7일 후에는 정상 쥐와 유사한 운동 능력을 보이는 것을 확인할 수 있었다. 김형민 박사팀이 개발한 뇌 자극기는 가벼운데다 무선이어서 신체적 움직임에 따른 제약 없이도 초음파로 뇌 운동 영역을 자극함으로써 뇌졸중으로 손상된 신경의 재활이 가능하다는 것을 보여주었다. 이러한 연구 결과는 머지않아 임상 수준에서의 착용형 초음파 뇌 자극 기술 개발에 활용될 수 있을 것으로 기대된다. KIST 김형민 박사는 “최근 착용형 뇌 자극 기술의 발전이 빠르게 이루어지고 있는 상황에서 착용형 초음파 기기를 이용한 비침습적인 뇌신경 재활 치료가 가능하다는 것을 입증했다 것이 본 연구의 의의”라며, “앞으로 자극 후 안전성과 질병 치료의 효과를 보장하기 위해서 초음파 자극을 통한 신경조절의 분자적, 세포적 메커니즘을 밝혀 및 자극 프로토콜을 최적화하는 후속 연구가 필요하다.”라고 밝혔다. 본 연구는 과학기술정보통신부(장관 최기영) 지원으로 국가과학기술연구회 창의형융합연구사업으로 수행되었으며, 이번 연구 결과는 의공학 분야 국제 저널인 ‘IEEE Transactions on Biomedical Engineering’ 최신 호에 게재되었다. * (논문명) Wearable transcranial ultrasound system for remote stimulation of freely moving animal - (제 1저자) 한국과학기술연구원 김예브기니 박사후연구원 - (교신저자) 광주과학기술원 김재관 부교수 - (교신저자) 한국과학기술연구원 김형민 책임연구원 <그림설명> [그림 1] 개발된 무선 착용형 뇌 자극 시스템을 사용한 동물 착용 예 [그림 2] (a)뇌졸중 쥐 모델의 대뇌 피질 운동 영역 저강도 집속초음파 자극 시뮬레이션 이미지(붉은 점이 초음파가 자극되는 지점) 및 (b)동물 착용형 뇌 자극 시스템을 사용하여 뇌졸중 쥐 모델 뇌 자극을 시행한 행동 분석 결과. 자동화된 동물 행동 추적 시스템으로 효능을 추적한 결과 뇌 자극을 시행한 뇌졸중 쥐(tFUS)에서 시행하지 않은 뇌졸중 쥐(Sham)에 비해 날짜가 지남에 따라 건강한 동물(Healthy) 과 유사한 활동성(붉은 선)을 회복하는 모습을 확인
- 39
- 작성자바이오닉스연구센터 김형민 박사팀
- 작성일2020.12.20
- 조회수9301
-
38
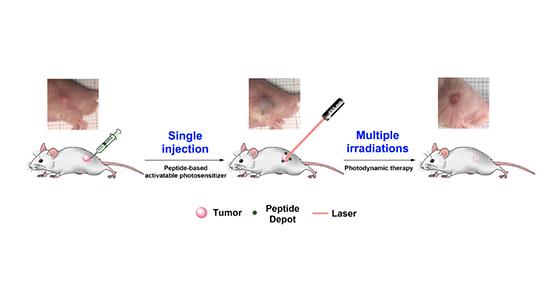
빛으로 하는 항암치료, 주사는 한 번만 맞으세요
- 한 번의 주사와 반복적인 광치료로 부작용 없이 항암치료 - 암 표적성 단일 성분 초분자 펩타이드 광치료제 개발 국내 연구진이 항암치료의 고통을 덜면서 효율성을 획기적으로 높이고, 치료 후 부작용까지 최소화할 광(光)치료 기술을 개발했다. 한국과학기술연구원(KIST, 원장 윤석진)은 테라그노시스연구센터(KU-KIST 융합대학원) 김세훈 센터장 연구팀이 서울대학교 이윤식 교수, 고려대학교 안동준 교수와의 공동연구를 통해 단 한 번의 주사와 반복적인 광치료로 부작용 없이 암을 완전히 제거할 수 있는 암 표적성 광치료제를 개발했다고 밝혔다. 빛을 이용한 암 치료 기술인 광치료 기술은 레이저에 반응하여 암세포를 파괴하는 광민감제를 주사를 통해 주입하여 암 조직에만 축적시킨 후 빛을 쏘아 선택적으로 암세포만 파괴할 수 있는 기술이다. 암세포 주변 조직에 피해가 불가피한 방사선 치료나 일반 화학 요법보다 부작용이 훨씬 적어 반복 치료가 가능하다. 하지만 광민감제는 1회 사용만 가능해 반복 치료를 위해서는 시술할 때마다 광민감제를 투여해야 하고, 치료 후 남아있는 광민감제가 피부나 눈에 축적되어 빛에 의한 부작용을 일으키기 때문에 치료 후 환자에게 일정 기간 햇빛, 실내조명 등으로부터 격리를 권장하고 있다. 이로 인해 치료를 받는 환자는 매번 주삿바늘의 아픔과 격리 생활이라는 또 다른 불편함을 겪어야만 했다. 최근에는 암 조직 내에서만 광치료 효능이 활성화되는 광민감제가 개발되고 있으나 여전히 독성이 있고, 시술할 때마다 주사해야 하는 문제점은 남아있었다. KIST 김세훈 박사팀은 광의학 치료기술의 문제점들을 해결하기 위해 암 조직만 선택적으로 표적하며 특정한 질서를 갖고 뭉쳐 스스로 조립되는 펩타이드를 활용했다. 연구팀은 암 조직을 선택적으로 투과 및 표적화할 수 있는 특성이 있는 고리형 펩타이드(iRGD, internalizing RGD peptide)를 골격으로 하고 광민감제와 빛에 대한 활성을 조절하는 소광제를 적절히 설계하여 암 조직 내에서만 광치료 효능이 활성화되는 펩타이드 기반의 광민감제를 개발했다. 개발된 광민감제는 생체에 주사하면 체온에 의해 활성화되어 연구팀이 설계한 초분자 배열로 뭉쳐 암세포 주변에 저장된 후 암세포를 표적으로 장기간 천천히 방출되어 암세포 내에 자리 잡는다. 이후 광치료를 시술하면 정상 세포는 파괴하지 않고 암세포만 파괴할 수 있게 된다. 연구진이 개발한 광치료제를 종양이 이식된 생쥐 모델에 적용한 결과, 암 조직 주변에 단 한 번 주사로 종양 주변에 저장된 광민감제가 장기간(2~4주) 지속해서 방출되어 종양을 선택적으로 표적하는 결과를 보여주었다. 뿐만 아니라 반복적인 광 노출에도 암 주변 조직 및 주요 장기가 파괴되는 독성이 발견되지 않았으며 반복적인 시술을 통해 암 조직이 완벽히 제거됨을 확인하였다. KIST 김세훈 센터장은 “생체 내에 주사하면 추가적인 보조제 없이도 초분자 자기조립을 통해 저장고를 형성하는 암 표적성 펩타이드 광치료제를 개발했다.”라며 “개발된 광치료제는 암 주변에 단 한 번 주사하는 것만으로도 독성 없이 장기간 반복적인 광치료를 통해 암을 완벽하게 제거할 수 있으며 단일 성분으로 제형이 단순하여서 향후 광의학 치료에 유용하게 활용될 것으로 기대된다.”라고 말했다. 본 연구는 과학기술정보통신부(장관 최기영) 지원으로 KIST 주요사업 등으로 수행되었으며, 이번 연구 결과는 나노기술 분야 국제 저널인 ‘ACS Nano’ (IF: 14.588, JCR 분야 상위 5.25%) 최신 호에 게재되었다. * (논문명) Injectable Single-Component Peptide Depot: Autonomously Rechargeable Tumor Photosensitization for Repeated Photodynamic Therapy? - (제 1저자) 한국과학기술연구원 조홍준 박사(現, 일리노이 주립대 박사후연구원) - (제 1저자) 한국과학기술연구원 박성준 박사(現, 한미약품 연구원) - (교신저자) 한국과학기술연구원 김세훈 책임연구원 - (교신저자) 서울대학교 화학생물공학부 이윤식 교수 - (교신저자) 고려대학교 화공생명공학과 안동준 교수 <그림설명> [그림1] KIST 연구진이 개발한 암 표적성 초분자 펩타이드 광치료제를 동물실험에 적용한 상황을 그린 모식도. 단 한 번의 초분자 펩타이드 광치료제 주사와 반복적인 광치료를 통하여 암을 완벽치료하였다.
- 37
- 작성자테라그노시스연구센터 김세훈 박사팀
- 작성일2020.12.11
- 조회수10633
-
36

각종 혈관질환 줄기세포 치료제, 실시간 관찰 통해 효능 예측한다
- 혈관으로 분화하는 줄기세포의 이식 초기 분포 영상을 통해 치료 효능 예측 - 혈관 재생을 위한 세포치료제 분야 연구에 응용 최근 식습관의 변화와 흡연, 음주로 인해 비만, 당뇨, 고혈압 등의 증가로 발끝이 썩어들어가는 중증하지혈과 같은 허혈성 질환의 고위험군 수가 증가하고 있다. 이러한 허혈성 질환을 치료하기 위해 새로운 혈관을 형성하는 줄기세포인 ‘혈관내피 전구세포’에 관한 연구가 활발하다. 혈관내피 전구세포는 허혈성 부위 등 혈관형성이 필요한 부위로 이동한 후 혈관의 내피세포로 분화하거나 혈관의 형성을 돕는 인자를 방출하여 혈관재생을 유도하기 때문에 허혈성 질환을 비롯한 혈관과 관련된 질환의 세포치료제로 개발할 수 있다. 그러나 혈관 재생능력이 뛰어난 혈관내피 전구세포를 혈관재생을 위한 세포치료제로 사용하더라도 치료 결과는 체내 이식된 세포의 생존, 치료 부위로의 이동과 같은 다양한 변수에 의해 다르게 나타나며 정확한 점이 있어 허혈성 질환의 치료제는 아직 상용화되지 못하고 임상단계에 머물러 있는 상황이다. 한국과학기술연구원(KIST, 원장 윤석진)은 테라그노시스연구센터 김광명 박사팀이 (주)T&R Biofab 문성환 박사팀과의 공동연구를 통해 혈관내피 전구세포의 체내 이식 후 초기 분포 및 이동을 형광 영상으로 추적하여 초기 이식된 혈관내피 전구세포의 분포에 따른 치료 효능을 예측할 수 있는 기술을 개발했다고 밝혔다. KIST 김광명 박사팀은 형광물질을 혈관내피 전구세포 표면에 결합시킨 후 형광분자단층촬영을 통해 식별 가능하게 했다. 그 후 중증하지허혈질환 쥐의 허벅다리에 이식된 세포를 28일 동안 영상을 통해 추적하여 세포의 체내 움직임을 확인하고, 레이저 측정을 통해 혈류가 복원되는 과정을 추적, 관찰하였다. 그 결과 혈관내피 전구세포가 허혈성 질환이 발생한 조직으로 이동하는 것을 확인할 수 있었다. 또한, 세포치료제 이식 초기에 혈관내피 전구세포를 촬영한 영상을 분석한 결과, 두 가지 형태로 주입된 것을 확인할 수 있었다. 하나는 응축되어 있는 ‘둥근 모양’, 다른 하나는 널리 퍼진 ‘확장된 모양’이었다. 이 두 가지 형태로 실험군을 분류하여 치료 효능을 관찰한 결과 처음 이식된 곳에 잘 응축되어 있던 ‘둥근 모양’의 실험군에서 세포가 더 잘 이동하고 치료 효능이 좋았음을 확인했다. 이를 통해 치료 초기에 치료제가 응축된 ‘둥근 모양’으로 형성되어야 앞으로의 치료 효능이 좋으리라는 것을 예측할 수 있었다. 본 연구를 주도한 KIST 김광명 박사는 “초기에 이식된 세포치료제의 형태 및 체내 초기 변화를 빠르고 정확하게 모니터링하는 기술은 이식된 혈관내피 전구세포의 허혈성 질환 치료효능을 초기에 예측할 수 있도록 하여 향후 허혈성 질환 치료를 위한 세포치료제 개발 분야에 활용될 것”으로 기대하고 있다. 본 연구는 과학기술정보통신부(장관 최기영) 지원으로 KIST 주요사업과 한국연구재단 중견연구자지원사업 등으로 수행되었으며, 이번 연구결과는 생체재료 분야 국제 저널인 ‘Biomaterials’ (IF: 10.317, JCR 분야 상위 1.316%) 최신 호에 게재되었다. * (논문명) Predicting in vivo therapeutic efficacy of bioorthogonally labeled endothelial progenitor cells in hind limb ischemia models via non-invasive fluorescence molecular tomography - (제 1저자) 한국과학기술연구원 임승호 박사과정 - (제 1저자) 한국과학기술연구원 윤홍열 선임연구원 - (교신저자) T&R Biofab 문성환 박사 - (교신저자) 한국과학기술연구원 김광명 책임연구원 <그림설명> [그림 1] 생물직교성 클릭화학을 이용한 혈관내피 전구세포의 형광 표지 및 하지허혈 쥐 모델에 이식 후 모니터링 모식도 [그림 2] FMT로 관찰한 이식된 혈관내피 전구세포의 시간에 따른 체내 이동 이미지 세포 이식 직후의 형광의 분포가 응축된 모양일 경우 형광으로 표지된 혈관내피 전구세포는 시간에 따라 배쪽 (혈관 폐색 부위)으로 이동하는 것을 볼 수 있음. 그러나 확장된 모양으로 이식된 혈관내피 전구세포는 배쪽으로의 이동 뿐만아니라 주변으로 확산되는 경향을 보이며, 28일째 형광이 관찰되지 않음 [그림 3] 혈관내피 전구세포 이식후 하지허혈 쥐 모델의 혈류 재생 및 사지괴사 모니터링 세포 주입 직후 응축된 모양으로 혈관내피 전구세포가 이식된 쥐에서 더 높은 혈류 재생 유도 및 사지 괴사 방지가 일어나는 것을 확인함
- 35
- 작성자테라그노시스연구센터 윤홍열 박사팀
- 작성일2020.11.22
- 조회수10387
-
34
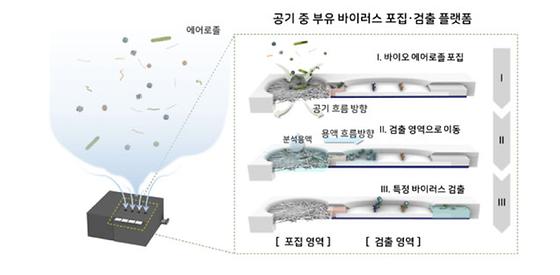
공기 중 바이러스, 현장에서 일회용 키트로 바로 검출!
- 공기 중 바이러스 포집 및 검출 일체형 진단 플랫폼 개발 - 일회용 포집·진단 키트를 이용한 부유 바이러스의 빠르고 선택적인 탐지 국내 연구진이 공기 중의 특정 바이러스를 현장에서 바로 검출할 수 있는 기술을 개발했다. 한국과학기술연구원(KIST, 원장 윤석진)은 분자인식연구센터 이준석 박사팀이 광주과학기술원(GIST, 총장 김기선) 화학과 김민곤 교수팀, 건국대학교 (총장 전영재) 수의학과 송창선 교수팀과의 공동연구를 통해 공기 중의 바이러스를 현장에서 포집하고 동시에 검출할 수 있는 진단 플랫폼을 개발했다고 밝혔다. 현재 공기 중에 퍼져있는 각종 세균, 곰팡이, 바이러스와 같은 생물학적 위해물질을 검사하기 위해서는 검사할 장소의 공기를 포집하고 포집한 공기를 실험실에 가져온 후 적게는 수 시간에서 길게는 수일이 소요되는 별도의 분석 공정이 필요하다. 실험실로 옮기지 않고 현장에서 바로 검사할 수 있는 기존 기술은 세균 또는 곰팡이의 농도를 모니터링할 수는 있었으나, 특정 미생물의 유무나 입자 크기가 작은 바이러스를 구별하는 데는 한계가 있었다. KIST-GIST 공동연구진은 공기 중의 바이러스를 현장에서 일회용 키트를 활용하여 손쉽게 포집하고 동시에 검출할 수 있는 일체형 진단 플랫폼을 개발했다. 연구진이 개발한 일회용 바이러스 포집·진단 키트는 임신 진단 키트와 유사한 형태로 별도의 세척이나 분리 없이 하나의 키트 내에서 10분~30분간의 포집 후 20분의 분석을 통해 현장에서 최대 50분 안에 포집, 분석의 모든 과정을 완료하여 손쉽게 부유 바이러스의 존재를 확인할 수 있다. 개발한 진단 플랫폼은 공기 채집기를 통해 부유 바이러스를 유리 섬유로 이루어진 필터인 다공성 패드에 수집, 농축하고 모세관 현상을 이용하여 검출 영역으로 이동시킨다. 이동한 바이러스는 특정 바이러스에만 반응하는 항체가 부착된 적외선 발광 나노입자와 결합되어 여러 바이러스가 공존하고 있는 환경에서도 원하는 바이러스를 선택적으로 검출할 수 있다. 또한, 이러한 진단 키트를 동시에 4개 이상 삽입할 수 있는 형태로 제작하여 동시에 여러 종류의 바이러스를 검출할 수도 있다. 부유 바이러스는 실내 공간의 크기, 공조 시스템의 유무, 온도 및 습도 등의 외부 요인에 영향을 받기 때문에 공동연구진은 개발한 플랫폼을 검증하기 위해 외부 요인들을 조절할 수 있는 인공 부유 바이러스 조성 시스템을 구축하여 일정한 조건에서 실험을 진행했다. 넓은 공간에 확산되어 있는 인플루엔자 바이러스를 포집하여 다공성 패드 내에서 약 100만 배 이상의 농도로 농축하였으며, 패드 표면에 부착된 바이러스들을 표면 전처리 및 분석용액 최적화를 통해 약 82% 수준의 효율로 회수하여 검출 영역으로 이동시켜 분석할 수 있었다. KIST 이준석 박사는 “현장에서 포집하고 바로 분석이 가능한 플랫폼으로 코로나19 바이러스와 같은 공기중에 부유 중인 생물학적 위해 인자를 현장 진단하여 실내 공기 오염 모니터링 시스템으로 응용할 수 있다.”라고 밝혔다. 본 연구는 삼성미래기술육성사업 지원으로 수행되었으며, 이번 연구 결과는 ‘ACS Sensors’ (IF: 7.333, JCR 분야 상위 2.907%) 최신 호에 게재되었으며, 표지논문으로 선정되어 출판될 예정이다. * (논문명) An Integrated Bioaerosol Sampling/Monitoring Platform: Field-deployable and Rapid Detection of Airborne Viruses - (제 1저자) 한국과학기술연구원 이인애 박사후연구원 - (제 1저자) 광주과학기술원 석영웅 박사후연구원 - (교신저자) 광주과학기술원 김민곤 교수| - (교신저자) 한국과학기술연구원 이준석 선임연구원 <그림설명> [그림 1] 표지논문 선정 이미지 [그림 2] 공기 중 바이러스를 포집하고 탐지하는 일체형 분석 플랫폼 개략도 공기 채집기를 통해 부유 바이러스를 다공성 패드에 수집 및 농축하고 모세관 작용을 이용하여 검출 영역으로 바이러스를 이동시킨다. 포집과 검출의 과정이 일회용 진단 키트 내에서 이루어져 현장에서 쉽고 빠르게 부유 바이러스 분석이 가능하다.
- 33
- 작성자분자인식연구센터 이준석 박사팀
- 작성일2020.11.12
- 조회수10979
-
32
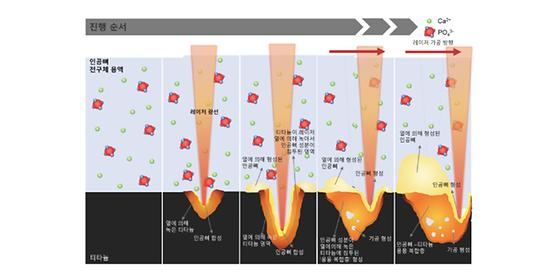
임플란트에 인공뼈 코팅해서 염증 해결한다
- 생산 공정 단계, 시간, 비용 대폭 줄이면서도 기존 임상 제품 보다 코팅 성능 우월 - 금속, 고분자 소재 표면에 인공뼈 합성과 코팅을 동시에 구현 인구 노령화와 함께 현대 사회로 발전하면서 골질환이 급증하고 있으며, 골질환 치료를 위한 치과용/정형외과용 임플란트의 사용이 증가하고 있다. A.D. 1세기경 로마시대에 철을 치아 대용으로 사용했을 정도로 임플란트의 역사는 오래되었다. 하지만 오랜 역사에도 불구하고 체내 뼈조직과 결합이 빨리 이루어지지 않아 헐거워지거나 염증이 생겨 2차 수술을 해야 하는 등의 문제가 발생한다. 뼈와 동일한 성분으로 이루어진 인공뼈를 임플란트 소재에 코팅하여 이러한 문제를 해결하기 위한 방법이 시도되고 있다. 기존의 인공뼈 코팅 방법들은 인공뼈 물질을 제작하기 위한 별도의 합성 공정 과정과 장시간의 코팅 공정 시간이 필요하다. 또한, 모재와 인공뼈 코팅층 간의 결합력이 약하여 쉽게 손상되거나 뜯겨 나가는 경우가 많아 실제 임상에서 환자에게 사용될 수 있을 만큼 강한 코팅 방법은 부족한 상황이었다. 그런 가운데, 한국과학기술연구원(KIST, 원장 윤석진) 생체재료연구센터 전호정 박사팀은 생체 이식용 재료 표면에 기존보다 세 배 이상 우수한 결합강도를 갖는 세라믹 인공뼈 코팅 기술을 개발했다고 밝혔다. KIST 연구진은 하루 이상의 시간과 수십 단계의 공정이 필요했던 기존 인공뼈 코팅을 단 하나의 공정만으로 한 시간 이내에 구현 가능한 기술을 개발했다. 이 공정 기법을 이용하면 인공뼈 코팅을 위한 원료 물질을 합성하는 별도의 과정도 필요하지 않고, 고가의 장비와 부수적인 열처리 과정 없이 나노초 레이저(nanosecond laser) 장비 하나만으로 코팅할 수 있다. 그 뿐만 아니라 현재 임상에서 사용되고 있는 소수의 인공뼈 코팅 기법들보다 더 강한 결합력을 갖는 코팅층을 형성할 수 있다. 또한, 이 공정을 사용할 경우에 금속 표면뿐만 아니라 기존의 공정으로는 구현하지 못하였던 정형외과용 플라스틱 임플란트 등 고분자 소재 표면에도 강한 코팅을 구현할 수 있는 장점이 있다. 전호정 박사팀은 공정 단계와 시간을 단축 하면서도 강력한 코팅을 구현하기 위해, 뼈의 주 성분인 칼슘과 인으로 이루어진 용액 속에 코팅 하고자 하는 재료를 위치시키고 레이저를 조사하는 방법을 사용했다. 이때 레이저의 초점 영역에 국소적으로 온도가 증가하면서 칼슘과 인 성분이 반응하여 세라믹 인공뼈(하이드록시아파타이트)가 합성되고 동시에 코팅층이 형성되었다. 이 방법은 기존의 코팅법들이 재료 표면에 코팅 하고자 하는 성분을 쌓아 올리는 방식과는 다르게, 레이저에 의해 인공뼈 성분의 합성이 일어나면서 동시에 재료의 표면이 녹는점 이상으로 가열되어 녹은 후 합성된 채로 다시 굳기 때문에 코팅 결합력을 극도로 증가시킬 수 있었다. KIST 전호정 박사는 “나노초레이저를 이용한 하이드록시아파타이트 코팅 기법은 현재 생체재료로 많이 사용되고 있는 티타늄, PEEK와 같은 생체비활성 소재의 표면을 간단한 방법으로 생체활성화 시킬 수 있는 기술로, 골융합을 필요로하는 다양한 의료기기로 확대 적용이 가능하게 하는 게임 체인저 역할을 할 수 있을 것으로 기대된다.”고 밝혔다. 본 연구는 과학기술정보통신부(장관 최기영) 지원으로 KIST 주요사업과 한국연구재단 중견연구자지원사업으로 수행되었으며, 이번 연구결과는 기능성 재료 분야 국제 저널인 ‘Advanced Functional Materials’ (IF: 16.836, JCR 분야 상위 3.981%) 최신 호에 게재되었다. * (논문명) Robust hydroxyapatite coating by laser-induced hydrothermal synthesis - (제 1저자) 한국과학기술연구원 엄승훈 학생연구원 - (제 1저자) 한국과학기술연구원 정용우 학생연구원(現, LASERVAL) - (교신저자) 한국과학기술연구원 전호정 책임연구원 <그림설명> [그림 1] KIST 연구진이 레이저를 이용하여 인골 뼈를 세계 최고속 수준으로 구현한 방법과 이로 인해 형성된 코팅층의 구조를 보여주는 모식도 [그림 2] 레이저를 이용한 인공뼈의 합성과 코팅이 동시에 일어나는 원리를 나타낸 모식도 [그림 3] 코팅 방법에 따른 인공뼈 코팅 강도 비교표
- 31
- 작성자생체재료연구센터 전호정 박사팀
- 작성일2020.10.06
- 조회수9673
-
30
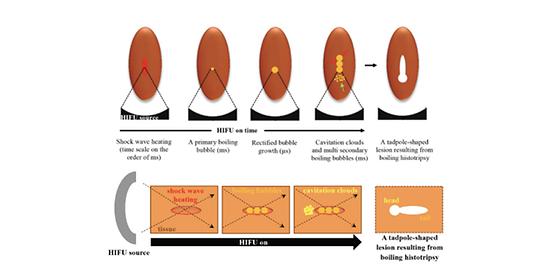
초강력 초음파로 수술없이 암, 종양 파괴한다
- 집속 초음파 기술에서 주변 조직을 파괴하는 2차 미세 기포 생성 원리 규명 - 타겟 생체 조직만을 정밀하게 제거할 수 있는 기반 마련 초음파 에너지를 신체 내 원하는 타겟 위치에 모아 고열을 발생 시키면 외과적 수술 없이 조직을 태워 괴사 시킬 수 있다. 현재 이러한 방법은 자궁근종, 전립선비대증, 전립선암, 전이성 골종양 등에서 종양을 열을 이용해 파괴하는 치료 방법으로 임상에서 다양하게 사용되고 있다. 하지만 고열을 통해 조직을 태우다보니 열확산 현상에 의해서 종양 주변 조직까지도 태울 수 있는 문제가 있다. 한국과학기술연구원(KIST, 원장 윤석진)은 바이오닉스연구센터 박기주 박사팀은 2019년에 기존 초음파 기술보다 수십 배 더 강력한 수십 메가파스칼(MPa)의 음향 압력 세기를 갖는 초음파, 즉 고강도 집속초음파를 이용하면 열에 의한 신체의 손상없이 칼로 자른 듯 종양을 깨끗하게 파괴할 수 있음을 확인하고, 그 원리를 밝혀낸 바 있다.(※Ultrasonics Sonochemistry. 2019, 53, 164-177) 열을 이용하지 않고 물리적으로 조직을 파괴하는 이 기술에서 강력한 초음파를 받은 목표 지점에는 수증기 기포가 생겨나는데, 발생되는 1차 기포의 운동에너지에 의해서 목표한 종양 조직을 물리적으로 파괴할 수 있다. 하지만 목표 지점뿐만이 아니라 그 주변에서도 순차적으로 주변에 2차로 여러 미세 기포들이 동시 다발적으로 생성되어 원치 않는 부위까지 파괴될 수 있어 이들의 생성 원인을 파악하고 발생 위치를 정확히 예측해야 할 필요가 있었다. KIST 연구팀은 후속연구를 통해 집속초음파를 이용하여 종양조직을 제거 할 때 생성되는 2차 미세 기포의 발생 원리를 밝히기 위해 수학 모델을 개발 하고, 초음파에 의해 생긴 1차 수증기 기포가 초음파 진행에 미치는 영향을 연구했다. 그 결과, 수증기 기포에 의해서 전방위로 퍼져나가는 초음파와 지속적으로 입사되는 집속 초음파의 간섭이 그 원인이고 간섭되는 범위에서 2차 기포가 발생한다는 사실을 밝혀냈다. 초고속카메라를 이용하여 촬영한 결과와 비교하였더니, 초음파가 간섭되는 범위와 2차 미세기포가 실제 생성되는 위치가 일치하는 것을 확인하였다. 이 연구 결과는 2차 미세 기포가 생성되는 원리를 설명 하는 것뿐만 아니라, 그 범위를 예측함으로써 보다 안전하게 타겟 조직만을 정밀하게 제거 할 수 있는 가능성을 제시하였다. KIST 박기주 박사는 “이번 연구는 초음파 초점에서 수증기 기포 발생 후에 초음파 산란효과에 의해서 미세 기포들이 순차적으로 생성된다는 것을 규명한 것으로, 개발된 수학 모델을 이용하면 기포의 발생 위치 및 파괴되는 종양 조직의 범위를 사전에 예측 하는 것이 가능할 전망이다.”라고 말하며, “개발하고 있는 초음파 기술이 외과적인 수술 없이 종양조직만의 물리적 파쇄가 가능한 초정밀 집속 초음파 수술 기술로 발전되어 향후 임상에서 적용되길 기대한다.”라고 밝혔다. 본 연구는 과학기술정보통신부(장관 최기영) 지원으로 KIST 주요사업 및 국가과학기술연구회 창의형융합연구사업 지원으로 수행되었으며, 연구결과는 음향(Acoustics) 분야 권위지인 ‘Ultrasonics Sonochemistry’ (IF: 6.513, JCR 분야 상위 1.562%) 최신호에 게재되었다. * (논문명) The interaction of shockwaves with a vapour bubble in boiling histotripsy: The shock scattering effect - (제 1저자, 교신저자) 한국과학기술연구원 박기주 선임연구원 <그림설명> [그림1] 고강도 집속초음파 기반 생체조직 파쇄 기술 개념도 [그림2] 2차 미세기포 생성 메커니즘 및 그 형상
- 29
- 작성자바이오닉스연구센터 박기주 박사팀
- 작성일2020.09.24
- 조회수9758