연구본부소개
-
28

원하는 조직재생치료를 줄기세포 주사 한 방으로 콕!
- 하이드로젤로 줄기세포를 감싸 보호하고, 원하는 대로 분화시키는 기술 개발 한국과학기술연구원(KIST, 원장 이병권) 생체재료연구단 송수창 박사 연구팀은 하이드로젤*로 줄기세포를 잘 감싸서 보호하고, 또, 줄기세포를 원하는 대로 분화시킬 수 있는 줄기세포 주사 기술을 개발했다고 밝혔다. *하이드로젤(Hydrogel) : 용매가 물이거나 물이 기본 성분으로 들어 있는 젤리 모양의 물질 줄기세포는 세포분열을 통한 증식 및 분화과정을 거쳐 자기 자신을 복제하거나 다른 종류의 세포를 생산할 수 있는 특이한 능력을 갖추고 있다. 이러한 능력 덕분에 줄기세포는 세포치료제의 원료로써 난치성, 퇴행성 질환이나 장기재생 등과 관련이 깊은 재생의학 분야에서 많은 주목을 받고 있으며, 미래 의학을 이끌어 나갈 글로벌 차세대 성장 동력으로 부상되고 있다. 기존에 세포치료제로서 개발된 줄기세포는 정맥주사, 복강주사, 치료 부위 직접 주입 등으로 인체 내에 투여되기도 하는데, 이렇게 주입된 치료용 줄기세포들은 그대로 전신에 퍼져 원하는 질환 및 부위에 대한 치료의 효율성이 떨어지는 한계점이 있었다. 또한, 줄기세포들이 체내에 들어오게 되면 험난한 체내 환경과 맞서야 해서 생존율 역시 떨어질 수밖에 없었다. 게다가, 줄기세포를 치료제로 쓰려면 줄기세포를 원하는 대로 분화시켜야 하는데, 줄기세포와 같이 도입된 생체소재에 생리활성기능이 없거나 줄기세포에 단순히 분화 인자를 혼합하는 방법들을 사용할 경우에는 줄기세포를 이용한 조직 맞춤형 치료가 어려웠다. KIST 연구진은 이러한 한계점을 극복하고자 상온에서는 액상 형태였다가 체온에서 빠르게 딱딱한 젤 형태로 변하는 특성을 갖는 하이드로젤로 줄기세포를 감싼 후 주사제재로 사용하였다. 이렇게 개발한 주사의 하이드로젤에는 줄기세포를 원하는 대로 분화시킬 수 있는 생리활성물질들을 자유롭게 도입할 수 있었다. 마치 레고를 조립하는 듯한 방법을 사용하여 생리활성물질들은 하이드로젤에 도입하였는데, 하이드로젤과 다양한 레고 조각(생리활성물질)들의 양과 비율을 손쉽게 조절할 수 있었다. 이에 따라 줄기세포의 생존 및 원하는 분화에 이로운 최적화된 생체 내 환경을 조성하여 조직재생의 효과를 극대화 시켰다. 이를 통하여 체내에서 하이드로젤에 함유된 레고 조각의 조립(생리활성물질의 미세한 조절)에 따라 중간엽 줄기세포의 골, 연골, 지방조직의 재생을 원하는 대로 이루어 냈다. KIST 송수창 박사는 “질환의 종류 혹은 크기에 따라 생리활성물질 종류와 투여량의 변화를 줌으로써 환자 맞춤형 조직재생기술뿐만 아니라 향후 연구를 통하여 면역치료, 항암치료 등으로 적용 범위가 확장될 것”이라고 밝혔다. 본 연구는 과학기술정보통신부(장관 유영민) 지원으로 KIST 주요사업으로 수행되었으며, ‘줄기세포 분화조절 기술’과 ‘줄기세포 연골조직 재생환경 최적화’의 연구 결과가 국제학술지인 ‘Biomaterials’(IF : 10.27, JCR 분야 상위 0.96%) 및 ‘Advanced Science’(IF : 15.80, JCR 분야 상위 4.61%) 최신호에 각각 2건이 게재되었다. * (논문명) 3D hydrogel stem cell niche controlled by host-guest interaction affects stem cell fate and survival rate (*Biomaterials) - (제1저자) 한국과학기술연구원 홍기현 연구원 (박사과정) - (교신저자) 한국과학기술연구원 송수창 책임연구원 * (논문명) FineTunable and Injectable 3D Hydrogel for OnDemand Stem Cell Niche (*Advanced Science) - (제1저자) 한국과학기술연구원 홍기현 연구원 (박사과정) - (교신저자) 한국과학기술연구원 송수창 책임연구원 <그림설명> [그림 1] 온도감응성 하이드로젤 및 생리활성물질 조절을 통한 맞춤형 조직재생 [그림 2] 생체 내 줄기세포 생리활성물질 종류 및 투여량 조절
- 27
- 작성자생체재료연구단 송수창 박사팀
- 작성일2019.08.12
- 조회수9939
-
26
동시 다중 표적 유전자 가위 기술 개발, 항암 면역 치료의 새로운 길 찾았다
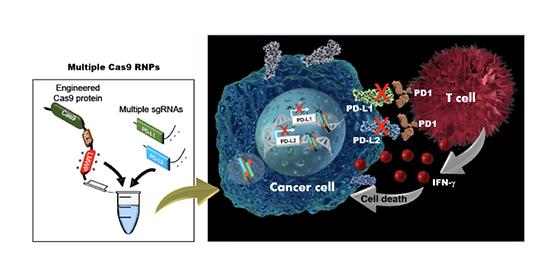
- 크리스퍼 가위 개량한 외부 전달체 필요없는 새로운 유전자 가위 기술 개발 - 악성 종양세포 단백질 억제 및 면역세포 활성화로 항암 면역 치료 기대 한국과학기술연구원(KIST, 원장 이병권) 테라그노시스연구단 장미희 박사팀은 세종대학교(총장 배덕효) 홍석만 교수팀과 공동연구를 통해 ‘혈액암 세포’*의 표면에 발현되는 면역체계를 방해하는 단백질들을 동시에 억제하고, 면역세포인 ‘세포독성 T 세포’**를 활성화시켜 항암 면역 치료가 가능한 새로운 유전자 가위 기술을 개발했다고 밝혔다. *혈액암 세포(lymphoma cell) : 혈액을 구성하는 성분에 생긴 암을 포괄적으로 이르는 말, 혈액이나 조혈기관, 림프절, 림프기관 등에 발생한 악성종양을 뜻함 **세포독성 T 세포(Cytotoxic T Lymphocyte, CTL) : T 림프구의 한 종류로, 세포독성물질을 분비하여 바이러스에 감염된 세포나 종양세포를 직접 파괴하는 면역세포 유전자 가위 기술은 특정 유전자를 제거하거나 정상적인 기능을 하도록 유전자를 편집함으로써, 질병의 근본적인 원인을 제거하여 치료할 수 있는 기술이다. 특히 유전자 가위 기술 중 하나인 크리스퍼 유전자 가위 기술***은 면역세포의 유전자를 선택적으로 교정함으로써 면역세포가 선택적으로 암세포만을 공격하도록 유도하는 면역 치료 요법으로 최근 각광을 받고 있다. ***크리스퍼 유전자 가위 기술 : 세균의 면역반응에 관여하는 단백질에서 유래한 것으로, 유전자의 절단 기능을 가지는 Cas9 단백질과 유전체 서열 선택성을 부여하는 single guide RNA (sgRNA)가 동시에 작용하여 유전자를 선택적으로 교정하는 기술 KIST 장미희 박사는 크리스퍼 유전자 가위를 외부 전달체 없이도 스스로 세포막을 뚫고 들어갈 수 있게 개량한 바 있다.(※ACS Nano ACS Nano2018, 12, 8, 7750-7760) 그러나 면역 활성을 조절하는 유전자의 종류가 다양할 뿐더러, 안전하면서도 간편하게 면역 치료를 유도하는 기술은 아직 부족한 실정이었다. KIST 장미희 박사팀과 세종대 공동연구진은 외부 전달체 없이 혈액암세포로 유전자를 전달할 수 있으면서도 여러 유전자를 동시에 효율적으로 교정할 수 있도록 크리스퍼 유전자 가위를 한 번 더 개량하여 면역 치료에 응용하는 기술을 개발하였다. 기존의 유전자 가위 기술을 이용한 방법으로는 면역세포 중 ‘T 세포’와 같은 혈액암 세포 내에 유전자를 전달하는 방식으로 주로 바이러스나 전기 충격 요법을 사용하였다. 바이러스를 이용한 방식은 원치 않은 면역 반응을 유도하는 경우가 많고 표적이 아닌 게놈 서열에 유전자가 잘못 삽입되어질 가능성이 높다. 또한 전기 충격 방식은 별도의 고가 장비가 필요하며, 전기 자극으로 대량의 세포를 한 번에 교정하기가 어렵고 세포생존도(cell viability)도 낮다는 단점을 가지고 있다. KIST-세종대학교 공동연구진이 개발한 이번 기술은 면역체계를 억제하는 것으로 알려진 면역 체크포인트**** 유전자 중 ‘PD-L1’, ‘PD-L2’ 두 개를 동시에 표적으로 한다. 이 면역 체크포인트를 표적으로 하여 면역 체계를 방해하지 못하게 유도하고, 결국 세포독성 T 세포가 암을 직접 공격할 수 있도록 하여 항암 면역 반응을 증가시키는 치료 효능을 확인하였다. ****면역체크포인트 : 암세포의 파괴를 방해하는 단백질 KIST 장미희 박사는 “새롭게 개발된 유전자 가위 기술은 다양한 면역세포에 적용가능하기 때문에, 암 뿐만 아니라 자가면역 질환, 염증성 질환 등 다양한 질병 치료제 개발에 적용 가능할 것으로 기대된다”고 밝혔다. 본 연구는 과학기술정보통신부(장관 유영민) 지원으로 KIST 기관고유사업과 한국연구재단 중견연구자지원사업으로 수행되었으며, 연구결과는 ‘Biomaterials’ (IF : 10.273, JCR 상위분야 : 1.56%)에 최신호에 게재되었다. *(논문명)A carrier-free multiplexed gene editing system applicable for suspension cells - (제 1저자) 한국과학기술연구원 주안나 박사 (박사후연구원) - (제 1저자) 세종대학교 이성원 박사 (박사후연구원) - (교신저자) 한국과학기술연구원 장미희 선임연구원 - (교신저자) 세종대학교 홍석만 교수 <그림설명> <그림 1> 다중 표적 유전자 편집 작동 원리 및 면역 치료 기전 <그림 2> 다중 표적 유전자 편집에 따른 T 세포 매개 암살상 능력 증가 확인
- 25
- 작성자테라그노시스연구단 장미희 박사팀
- 작성일2019.07.18
- 조회수10112
-
24
‘터미네이터’의 T-1000처럼 휘거나 잘려도 치유되고, 전력 전송 가능한 웨어러블 디바이스 신소재 나온다
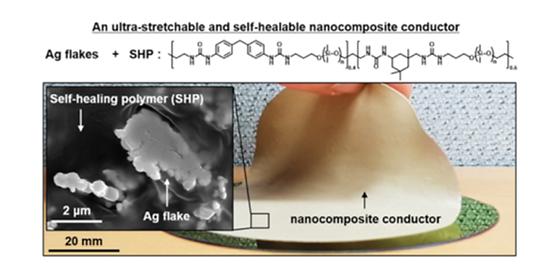
- 높은 신축성과 전도성, 자가 치유 특성 지닌 고분자 복합 신소재 개발 - 외형 변형 후, 전기전도도가 60배 이상 향상되는 셀프-부스팅 현상 규명 한국과학기술연구원(KIST, 원장 이병권) 바이오닉스연구단 손동희 선임연구원, 생체재료연구단 서현선 연구원 팀은 공동 융합연구를 통해 우수한 신축성을 가지며, 큰 변형이 있어도 높은 전도성을 유지할 뿐만 아니라 자가 치유(Self-healing) 특성까지 지니고 있는 신소재를 개발했다고 밝혔다. 최근 차세대 웨어러블 디바이스 개발에 관심이 모아지고 있다. KIST 손동희 박사는 사전에 실제 피부와 기계적 강도가 유사하여 부착 시 이질감을 느끼지 않아 장기간 착용이 가능하고, 신축성이 매우 뛰어나며 물이나 땀에서도 외부 자극 도움 없이 자가 치유 성능을 보이는 고분자 소재를 개발한 바 있다. (※ Advanced Materials 30, 1706846, 2018) KIST 손동희·서현선 연구팀은 이번 연구를 통해 기존의 특성을 유지하면서, 전자 소자와 인체 사이에 안정적으로 전력 및 데이터를 전송할 수 있는 높은 전도성과 신축성을 지니고 있어 ‘인터커넥트’*로 활용될 수 있는 신소재를 개발하였다. *인터커넥트(Interconnect) : 인체로부터 측정한 생체 전기신호를 전자 소자로 안정적으로 전달하기 위해 인체와 전자 소자 사이를 연결하는 장치 KIST 연구팀은 신축성이 높은 자가 치유 특성을 지닌 고분자의 내부에 은 마이크로·나노 입자들을 분산·분포시켜, 우수한 신축성을 가지면서도 변형에도 문제없는 전도성 고분자 복합 신소재를 제작하였다. KIST 연구진은 개발한 소재를 인터커넥트로 활용하여 실제 인체에 부착해 생체 신호를 실시간 측정하고, 이 신호를 안정적으로 로봇 팔에 전송하여 실제 인간 팔의 움직임을 실시간으로 그대로 모방하는 데에 성공하였다. 또한, 기존의 소재들은 변형이 일어날 경우 전기전도도가 약해져 그 성능이 떨어지는데 반해, KIST 연구진이 개발한 신소재는 초기 상태의 35배(3500%)까지 변형이 가능하며, 오히려 변형될수록 전기전도도가 60배 이상 좋아져 종래에 보고된 적 없는 세계 최고 수준의 전기전도도를 보인다. 뿐만 아니라, 손상되거나 완전히 절단되더라도 스스로 회복 및 접합되는 자가 치유 장점을 가져 학계의 주목을 받고 있다. KIST 연구진은 기존의 전도성 소재에서 보고된 바 없는 현상에 대해 규명했다. 연구진이 개발한 신소재는 외력에 의해 변형이 일어나면 내부 마이크로·나노 입자들의 재배열에 의해 전기적 특성이 자발적으로 향상되는 ‘셀프-부스팅(self-boosting)’현상이 나타나는 것을 발견하고, 주사전자현미경(in-situ SEM) 및 마이크로 CT(microcomputed tomography, μ-CT) 분석을 통해 원인을 규명하였다. KIST 서현선 연구원은 “개발한 소재는 극심한 외력 및 변형에서도 안정적으로 구동할 수 있어 차세대 웨어러블 전자기기 개발 및 상용화에 기여할 수 있을 것” 이라고 말했으며, KIST 손동희 박사는 “이번 연구 성과는 4차 산업혁명시대를 이끌 의공학, 전자공학, 로봇공학 분야에서 필요로 하는 소재 원천기술로, 다양한 분야에 응용될 수 있을 것으로 기대한다.”고 밝혔다. 본 연구는 과학기술정보통신부(장관 유영민) 지원을 바탕으로 KIST 기관고유사업으로 수행되었으며, 美 스탠포드 대학과 공동연구로 진행된 이번 연구결과는 국제학술지 ‘ACS Nano’(IF : 13.709, JCR 4.035%) 최신호에 게재되었다. * (논문명) An ultrastretchable and self-healable nanocomposite conductor enabled by autonomously percolative electrical pathways - (제1저자) 한국과학기술연구원 서현선 연구원 - (교신저자) 한국과학기술연구원 손동희 선임연구원 <그림설명> <그림 1> 고 신축성, 고 전도성, 자가 치유 고분자 복합체의 구조식, 미세구조 및 사진 <그림 2> 3500%까지 변형한 고분자 복합체의 사진(a) 및 전기전도도(b) <그림 3> 외력에 의한 변형이 유지되었을 때 은 나노입자의 자발적 동적 재배열 (셀프-부스팅 현상 규명) <그림 4> 완전한 절단 후에도 자가 치유되어 신축성 및 전도성 회복이 가능한 고분자 복합체 <그림 5> 인간-로봇 인터커넥트로 작용하여 인간의 팔 움직임을 로봇 팔에게 전달할 수 있는 고분자 복합체
- 23
- 작성자바이오닉스연구단 손동희, 서현선 박사팀
- 작성일2019.06.04
- 조회수12150
-
22
고강도 초음파로 종양 조직 제거하는 메커니즘 최초 규명
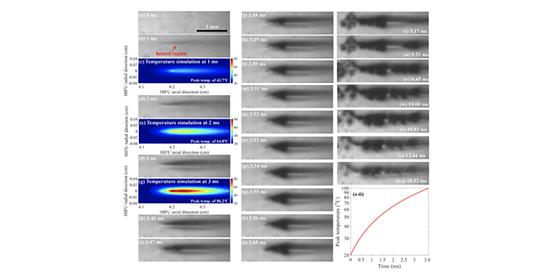
- 수학적 모델링 개발, 실측·동물실험 검증으로 초음파의 연조직 제거 기작 규명 - 수술 없이 초음파로 원하는 세포만을 선택하여 제거하는 연구 기반 마련 초강력 초음파 에너지를 한 곳에 집중시켜 초점 부위 조직을 제거하거나 치료하는 고강도집속초음파기술이 차세대 의료기술로 주목받고 있다. 외과적 수술 없이 종양 제거가 가능해정상조직의 부작용이 적고 회복 시간도 빨라 실제 임상 적용을 위한 다양한 연구가 진행되고 있다. 최근 국내 연구진이 수학적 모델링 기법과 초고속카메라를 이용한 실험을 통해 집속초음파의 연조직 제거효과 메커니즘을 최초로 규명하여 주목받고 있다. 한국과학기술연구원(KIST, 원장 이병권) 바이오닉스연구단 박기주, 김형민 박사팀은 영국런던대학교(University College London) 기계공학과 사파리(Saffari) 교수팀과 공동 연구를 통해 강력한 초음파 영역에서 발생하는 음향 공동현상*을 예측하는 수학적 모델을 개발하고, 집속초음파의 연조직 제거효과 메커니즘을 학계 최초로 규명했다고 밝혔다. *음향 공동현상(acoustic cavitation): 액체 내 압력 변화에 의해 기포(버블, 공기방울)가발생하는 현상 또는 액체 내에 이미 존재하고 있는 기포가 압력 변화에 따라 진동 및 붕괴하는 현상. 대기압의 수백 배에 달하는 수십 메가파스칼(MPa)의 압력 세기를 갖는 고강도집속초음파는 1000분의 1초 남짓한 짧은 시간에 초점 부위의 온도를 끓는점까지 올릴 수 있다. 이때초점에서 발생한 수증기 기포의 운동에너지를 이용하면 주변 세포 조직을 물리적으로 제거할 수 있다. 이러한 원리를 이용한 다양한 의료기술이 연구되고 있지만 아직 관련 현상을 완벽하게 설명하는 메커니즘은 밝혀지지 않았다. KIST 연구팀은 먼저 강력한 초음파 영역에서 발생하는 음향 공동현상의 운동변화를 예측할 수 있는 수학적 모델을 개발하고 이를 이용해 세포 조직의 변형률을 계산했다. 이어 인체조직 모사실험을 수행하고, 이때 발생한 공동현상을 초고속카메라로 촬영했다. 연구진은 정확도를 검증하기 위해 수학적 모델을 이용해 예측한 값과 초고속카메라 촬영 결과를 동일조건에서 비교 분석했다. 그 결과, 기포의 운동에 의해 발생하는 강도는 연조직을파괴할 수 있을 만큼 강하면서, 혈관이 파괴될 수 있는 강도 보다는 약하다는 것을 밝혀냈다. 이 결과는 고강도 집속초음파의 연조직 제거효과의 메커니즘을 규명하는 것뿐만 아니라, 기포의 운동 변화 및 강도를 조절하면 원하는 세포조직만을 선택적으로 제거 할 수 있는가능성을 제시하였다. KIST 박기주 박사는 “이번 연구는 초음파를 이용한 연조직 제거 메커니즘을 학계 최초로규명한 것으로 수학적 모델링 기법으로 최적화된 초음파 조사조건을 찾으면 외과적 수술 없이도 종양치료 및 특정 세포만을 선택하여 제거하는 것이 가능할 전망이다.”라고 설명했다. KIST 김형민 박사는 “지속적인 연구를 통해 향후 항암면역치료와 세포이식술 분야 등에도활용되는 기술로 발전하길 기대한다.”라고 밝혔다. 본 연구는 KIST 기관고유사업 및 국가과학기술연구회 창의형 융합연구사업 지원으로 수행되었으며, 연구결과는 ‘Ultrasonics Sonochemistry’ (IF: 6.01, 음향 관련 연구 논문 분야순위 1위, JCR 분야 상위 1.61%)에 최신호에 게재됐다. *(논문명) Mechanical damage induced by the appearance of rectified bubble growth in a viscoelastic medium during boiling histotripsy exposure - (제1저자, 공동 교신저자) 한국과학기술연구원 박기주 포닥연구원(전문연구요원) - (공동 교신저자) 한국과학기술연구원 김형민 선임연구원 <그림설명> <그림 2> 인체조직 모사 실험에서 측정한 수증기 기포의 크기와 컴퓨터 시뮬레이션을 이용해 예측한 기포 크기 비교 결과. <그림 3> 수증기 기포의 운동변화로 발생하는 세포 조직의 변형률을 나타내는 시뮬레이션 결과. G = 전단탄성률 (shear modulus) <그림 4> 집속초음파 연조직 제거효과(boiling histotripsy)에 의해 물리적으로 제거된 동물 간 조직
- 21
- 작성자바이오닉스연구단 박기주, 김형민 박사팀
- 작성일2019.01.22
- 조회수11809
-
20
현장에서 바로 조기 진단 가능한 조류인플루엔자(AI) 바이러스 검출 신기술 나왔다
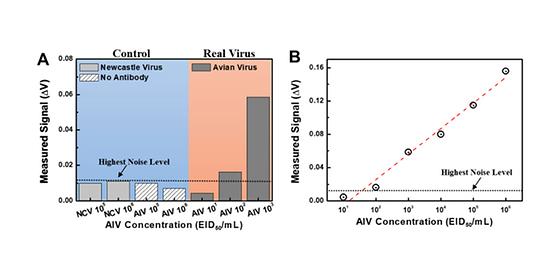
- 기존보다 1,000배 이상의 고감도 검출 가능한 반도체 바이오센서 개발 - 이동식 AI 바이러스 진단 키트 개발, 신속한 오염현장 방역체계 기대 최근 조류인플루엔자(AI, Avian Influenza) 바이러스는 고전염성 호흡기 질병의 주요 원인으로, 국내에서도 매년 주기적으로 발생해 경제적 손실은 물론 국민 건강에 큰 위협이 되고 있다. 최근에는 2개 이상의 바이러스 유형이 동시에 발생하는 등 대규모 피해 사례가 증가하고 있어 조기 진단과 방역체계 구축이 시급하다. 이런 가운데 국내 연구진이 이동식 측정이 가능한 새로운 AI 바이러스 검출 방법을 개발했다. 한국과학기술연구원(KIST, 원장 이병권) 생체재료연구단 이관희 박사팀은 건국대학교 수의학과 송창선 교수팀과 공동 연구를 통해 이동식 측정이 가능한 전기 신호 기반의 반도체 바이오센서를 제작하고, 현장에서 안정적으로 AI 바이러스를 검출할 수 있는 진단 플랫폼을 개발했다고 밝혔다. 기존 현장 진단 키트로 사용하고 있는 금 나노입자 기반의 래피트 키트*는 육안으로 신호를 확인해 사용이 편리하지만, 감도가 낮고 검사용 대상에서 바이러스를 구별하기 어렵다는 단점이 있었다. 또 감도가 낮아 농가나 계류장과 같은 야외에서 AI 바이러스를 조기 검진하는 데 한계가 있었다. *래피트 키트 : 임신 진단기와 같이 현장에서 시료를 적용하면, 두 줄의 선이 나타나는지 확인하여 진단하는 현장 진단 키트. KIST 이관희 박사팀은 이러한 한계를 극복하기 위해 검출 신호를 뚜렷하게 구별하고 인지할 수 있는 전기 신호 방식의 박막 반도체 바이오센서를 제조하고, 현장에서도 측정이 가능하도록 이동식 패키징에도 성공했다. 이렇게 개발한 바이오센서가 이동형이라는 강점을 활용하여 건국대학교 수의과대학 BSL(Bio Safety Level)-3* 시설로 측정 시스템을 운반해 측정한 결과, 기존 검출 키트에 비해 고위험군 AI 바이러스를 1,000배 이상 고감도로 검출할 수 있다는 사실을 확인했으며, 뉴캐슬 바이러스처럼 AI의 오진을 일으키는 유사 바이러스와도 구별이 가능하다는 것도 입증했다. *BSL-3 : 고위험군 바이러스의 경우 음압시설을 갖춘 BSL-3 등급의 실험실에서 실험을 진행해야 함. 기존의 전기신호 센서는 이동식 패키징이 되지 않아 저위험군 바이러스 검출에만 한정되어 있었음. KIST 이관희 박사는 “이번 연구를 통해 고병원성 AI 바이러스를 현장 시료에 영향을 받지 않고 안정적이고 고감도로 검출할 수 있는 플랫폼을 개발했다”라며 “이동식 전기신호 바이오센서 기술을 이용하여 신속성과 정확성, 경제성, 사용 편의성을 갖춘 보급형 이동식 센서를 상용화한다면 AI의 신속한 현장 진단 및 방역체계 구축에 기여할 것으로 기대한다.”라고 밝혔다. 본 연구는 과학기술정보통신부(장관 유영민) 지원으로 한국연구재단 바이오의료기기개발사업과 국가과학기술연구회 창의형융합연구사업으로 수행되었으며, 연구 결과는 나노분야 권위지인 ‘ACS Nano’(IF: 13.709, JCR 분야 상위 4.035%) 최신호에 게재되었다. * (논문명) Fully-Packaged Portable Thin Film Biosensor for the Direct Detection of Highly Pathogenic Viruses from On-Site Samples - (제1저자) 최재원 연구원 (KIST 석사 연구원) 전민홍 박사(KIST 박사후 연구원, 현 BISTEP 선임연구원) - (교신저자) 한국과학기술연구원 이관희 책임연구원 <그림설명> <그림 1> 조류인플루엔자 바이러스의 고감도 현장검출을 위한 반도체 박막 바이오센서 진단플랫폼의 모식도 및 사진 <그림 2> 뉴캐슬바이러스 등 유사 바이러스에는 반응하지 않으나, 조류인플루엔자 바이러스는 102의 초고감도 현장검출 성능을 보인 반도체 박막 바이오센서의 테스트 결과
- 19
- 작성자생체재료연구단 이관희 박사팀
- 작성일2019.01.21
- 조회수11538
-
18

암 세포까지 안전하게, 높은 항암효과 보이는 암 표적 약물 전달체를 손쉽게 발굴하는 기술 나왔다
- 암 표적 약물전달체로 DNA 나노구조체 이용, 최적의 약물 전달체 발굴 기술 - DNA 조합으로 다양한 종류의 나노입자 라이브러리 구축, 맞춤형 항암제 개발 기대 효과적인 암 치료를 위해서는 항암제가 암 조직에 정확하게 전달되고, 암 조직이 아닌 다른 장기로 전달되어 발생하는 부작용을 최소화하는 것이 중요하다. 이를 위해 다양한 종류의 나노입자 기반 암 표적 약물 전달체 연구가 진행되고 있지만, 현재까지 나노입자의 암 조직 도달량은 주입량 대비 평균 0.7% 정도에 불과한 실정이다. 최근 국내 연구진이 DNA 분자의 자기조립 성질을 이용하여 고성능 암 표적 전달체를 간편하게 발굴할 수 있는 기술을 개발했다고 밝혔다. 한국과학기술연구원(KIST, 원장 이병권) 테라그노시스연구단 안대로 박사팀은 DNA 서열과 DNA의 화학 성분을 다양하게 조합하는 연구를 수행하여 16개 종류의 DNA 나노입자로 구성되는 라이브러리를 구축했으며, 이러한 나노입자 라이브러리 검색을 통해 간편한 고성능의 암 표적 약물 전달체 발굴 방법을 개발했다고 밝혔다. 항암치료를 위해 암 세포에만 약물이 전달되는 표적 전달체용 나노입자의 개발은 상당히 까다롭다. 그 이유는 나노입자가 몸 안에 주입되면 예측하기 힘든 다양한 생체 내 장애물로 인해 암 세포까지 도달하지 못하여 기대만큼의 항암효과를 보지 못하기 때문이다. 이 문제를 해결하기 위해서는 다양한 나노입자를 한꺼번에 설계·제조하여 나노입자 라이브러리를 구축한 뒤, 모든 방해요소를 극복하고 암 세포에만 많이 도달하는 최적의 나노입자를 동물 모델 실험을 통해 선별하는 방법이 필요하다. 또한, 기존 소재를 이용하여 약물 전달체 나노입자를 제조할 경우, 모양을 정밀하게 제어하거나 다양한 화학 성분을 조합하는 것이 힘들어 여러 가지 나노입자로 구성되는 라이브러리 구축에 어려움을 겪어 왔다. KIST 안대로 박사팀은 1나노미터(nm, 10억분의 1m) 이하 수준으로 정밀하게 크기 및 모양 제어가 가능한 DNA 염기서열 기반 나노 구조체를 약물 전달체로 활용하였다. DNA는 생명 분자로 잘 알려져 있지만, 염기 서열을 분자설계 코드로 활용하면 다른 소재로는 불가능한 다양한 형태와 크기의 나노구조체를 매우 정밀하게 조절하여 만들 수 있다. 연구팀은 다양한 DNA 종류와 서열 순서를 조합하여 모양과 화학적 성분이 다른 여러 개의 나노입자로 구성되는 라이브러리를 구축했다. 또한, 안대로 박사팀은 이렇게 구축한 DNA 나노입자 라이브러리를 동물 모델에서 검색하여, 기존에 보고된 다른 암표적성 나노입자보다 약 3배 이상의 전달률을 보이는 고성능 암 표적 전달체 3종을 발굴하는 데 성공했다. 발굴된 전달체에 저분자 항암제 및 단백질 항암 약물을 탑재하여 암 질환 동물 모델에 주입했을 때, 다른 장기에는 손상을 주지 않고 암 조직에만 선택적으로 약물이 도달해 높은 항암 효능을 보였다. KIST 안대로 박사는 “이번 연구를 통해 개발한 DNA 나노입자 라이브러리 기반 약물 전달체 검색 기술을 활용하면 암 조직에 선택적인 약물 전달체를 개발할 수 있다.”라면서 “특히 뇌처럼 약물이 도달하기 힘든 조직을 포함해 다양한 표적 세포와 조직에 선택적이고 효율적으로 약물을 전달할 수 있는 전달체를 신속하고 간편하게 발굴할 수 있을 것으로 기대한다.”라고 밝혔다. 본 연구는 과학기술정보통신부(장관 유영민) 지원으로 KIST 기관고유사업과 한국연구재단 미래유망융합파이오니아사업 및 방사선기술개발사업으로 수행되었으며, 연구 결과는 ‘Biomaterials’(IF: 8.806, JCR 분야 상위 0.641%) 최신호에 온라인 게재되었다. * (논문명) Highly tumor-specific DNA nanostructures discovered by in vivo screening of a nucleic acid cage library and their applications in tumor-targeted drug delivery - (제1저자) KIST 테라그노시스연구단 김경란 박사(박사후 연구원) - (교신저자) KIST 테라그노시스연구단 안대로 박사(책임연구원) <그림설명> [그림 1] DNA 나노입자 라이브러리 검색을 통한 암조직 선택적 나노입자 약물전달체 개발 개략도. Dox: 독소루비신 (저분자 항암약물), CASP3: 케스파아제-3 (단백질 항암물질) [그림 2] 동물 모델 상 암조직 선택성 검색. (a) 각 나노입자 별 상대적인 암조직 선택성 간 조직 대비 암조직 도달 정도 (tumor-to-liver ratio, T/L) T/L이 높을수록 암조직 선택성이 높음. (b) 기존의 타 소재 기반 나노입자 대비 라이브러리 검색을 통해 발굴 된 고성능 암표적 DNA 나노입자(L-Py)의 암조직 선택성능(relative tumor specificity)의 우월성
- 17
- 작성자테라그노시스연구단 안대로 박사팀
- 작성일2019.01.15
- 조회수11564
-
16
유아의 소변 검사만으로 통증 없이 정확하게 성조숙증 진단한다
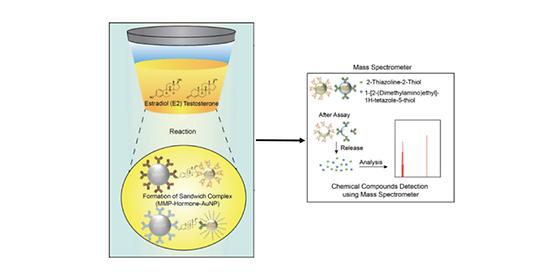
- 개발한 나노입자 주입, 세계 최고 수준의 감도로 소변 내 다양한 성호르몬 검지 - 채혈 필요없는 비침습적 방법, 향후 어린이들의 성조숙증 진단기술 발전 기대 최근 생활환경과 식생활 등의 변화로 보통 사춘기 현상에 나타나는 2차 성징에 대한 징후들이 8~9세 여아 혹은 남아에게 나타나 성조숙증 진단을 받는 어린이들이 늘고 있다. 이러한 성조숙증은 급격한 신체 변화로 정신적 스트레스를 유발할 수 있고, 비정상적인 성장으로 각종 질병에 노출될 수 있어 사회적인 문제로 대두되고 있다. 성조숙증 치료를 위해서는 무엇보다 빠른 진단이 중요한데, 국내 연구진이 통증 없이 빠르고 정확하게 성조숙증을 진단하는 기술을 개발했다. 한국과학기술연구원(KIST, 원장 이병권) 생체재료연구단 이효진‧이관희 박사팀과 도핑콘트롤센터 김기훈 박사팀은 공동연구를 통해 비침습적 호르몬 검지법을 개발하고, 어린이 소변에 극미량으로 존재하는 성호르몬을 세계 최고의 감도 수준으로 검지(檢知)하는데 성공했다고 밝혔다. 현재 성조숙증 진단에 사용되는 ‘호르몬 방출 검사(성선자극 호르몬 검사)’는 유도제 주사 후 일정한 간격으로 채혈하여 주사 전과 후의 호르몬 수치를 비교하는 방식이다. 이 때문에 어린이들은 반복적 채혈로 인한 통증과 이로 인한 심리적 부담감을 호소해왔으며, 인위적으로 자극을 가해 호르몬을 측정하기 때문에 검사 대상자의 신체 환경 및 주변 요인이 검사 결과에 영향을 미치는 단점이 있었다. KIST 연구진은 이 같은 문제점을 극복하기 위해 소변 속 여성 호르몬 에스트라디올(Estradiol)과 남성 호르몬 테스토스테론(Testosterone)을 표시하는 나노 입자를 도입하고, 질량분석기 신호를 증폭하여 한 번에 여러 종류의 호르몬을 효과적으로 검지하는 비침습적 방법을 개발하는 데 성공했다. KIST 연구진은 먼저 특정 호르몬을 검지할 수 있는 항체와 압타머(Aptamer)*가 부착된 나노입자에 이온화가 용이한 화학물질을 동시에 도입했다. 이때 각 호르몬을 대표하는 화학물질을 다르게 도입하여 마치 물건을 살 때 바코드로 상품 정보를 확인하듯 질량분석기가 이들 특정 화학물질을 검지하면서 타켓을 표적하여 성 호르몬의 존재 여부를 확인할 수 있게 하였다. *압타머 : 표적분자에 높은 친화성과 특이성으로 결합할 수 있는 특징을 가진 단일가닥 핵산(DNA, RNA 또는 변형핵산). 본 연구에서는 호르몬을 선택적으로 검지할 수 있는 압타머를 사용했다. 연구진은 실험을 통해 이 같은 비침습적 호르몬 검지법이 사람의 소변 환경에서 안정적으로 작동한다는 사실을 규명했다. 또 소변 내 호르몬을 직접 질량분석기로 검출하는 방법보다 연구진이 개발한 나노입자에 부착된 바코드 화합물을 이용해 검출했을 때 약 1만 배 이상의 신호 증폭 효과가 나타난다는 점도 확인했다. 이는 학계에 보고된 호르몬 검지능 중 최고 수준(100 아토그램퍼밀리리터(ag/ml, 10–18 g/ml))이다. KIST 이효진 박사는 “바코드가 물건 정보를 알려주듯, 화학물질이 바코드 역할을 하는 원리”라며, “향후 호르몬뿐 아니라 소변 내 검지가 어려웠던 다양한 저분자 검지에도 활용될 수 있을 것으로 기대한다.”라고 말했다. KIST 이관희 박사와 김기훈 박사는 “이번 연구 성과는 국내 연구진이 개발한 생명과학과 화학 분야의 융합 원천 기술로, 소아비뇨기과와의 공동연구를 통해 임상적 유의성을 분석하는 연구를 기획하고 있다”라고 밝혔다. 본 연구는 과학기술정보통신부(장관 유영민) 지원으로 한국연구재단 이공분야 기초연구사업(대통령Post-Doc.펠로우십)과 바이오의료기술개발사업으로 수행되었으며, 연구 결과는 「센서와 액추에이터 B: 케미컬(Sensors and Actuators B: Chemical)」 (IF : 5.667, JCR 분야 상위 2.459%) 최신호에 게재되었다. * (논문명) Non-invasive molecular barcode assay for diagnosis of sex hormones correlated with precocious puberty - (제1저자) KIST 생체재료연구단 이효진 박사(선임연구원) - (교신저자) KIST 도핑콘트롤센터 김기훈 박사(선임연구원) KIST 생체재료연구단 이관희 박사(책임연구원) <그림설명> [그림 1] (좌) 소변 내 다중 호르몬 검지 기술 모식도 (우) 바코드 화학물질의 질량 분석 방법 [그림 2] 소변 내 존재하는 2종의 호르몬 Estradiol과 Testosterone의 바코드 화학물질 질량 분석 결과, 검지능 약 10 ag/ml 수준으로 기존 방법 대비 10000배 (1 만배) 감도 향상을 보임
- 15
- 작성자생체재료연구단 이효진, 이관희 박사팀, 도핑콘트롤센터 김기훈 박사팀
- 작성일2018.12.04
- 조회수11418
-
14
POSTECH-KIST, 공진화(共進化) 잔해물의 단백질 분해신호 발견 5년간 연구 끝 새로운 생명의 비밀 밝혀내
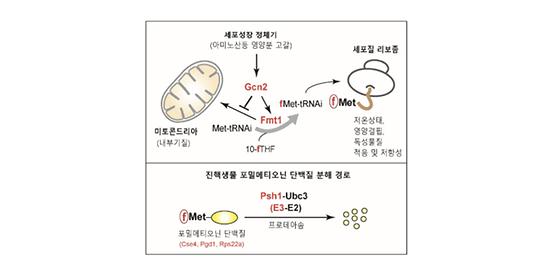
POSTECH(포항공과대학교) 황철상 교수와 한국과학기술연구원(KIST) 이철주 책임연구원 팀은 단백질 합성을 위해 필요한 효소, 포밀메티오닐-트랜스퍼라제가 극한 환경에서 진핵생물이 살아남을 수 있도록 하는 메커니즘을 밝혀냈다. 또, 이 효소가 단백질의 수명을 결정짓는 분해에도 관여한다는 새로운 사실도 발견, 이 성과를 과학 분야 권위지인 사이언스(Science) 8일자(현지 시간)를 통해 발표했다. 세균과 같은 원핵생물과 다세포 생물인 진핵생물의 생명현상은 비슷해 보이지만, 그 현상을 일으키는 단백질의 합성 방식에서 차이가 난다. 진핵생물은 아미노산 ‘메티오닌’부터 단백질을 만드는 반면, 원핵생물은 메티오닌의 변형체인 포밀메티오닌부터 단백질을 만들어나간다. 그러나, 세포 속에서 에너지를 생산하는 ‘미토콘드리아’의 경우에는 원핵생물처럼 포밀메티오닌부터 단백질 합성을 시작하기 때문에 생물학자들은 세포 속에서 에너지를 생산하는 ‘미토콘드리아’의 기원을 원핵생물이 공진화(共進化)해 진핵생물로 편입되었다고 보고 있다. 공진화란, 한 생물집단이 진화하면 이 집단과 관련된 집단이 같이 진화하는 현상을 의미한다. 숙주와 기생생물의 관계가 바로 이러한 공진화의 사례 중 하나다. 재미있는 것은 미토콘드리아에서는 포밀메티오닌을 이용해 단백질을 합성하더라도, 미토콘드리아를 제외한 다른 세포질은 메티오닌을 이용해서 단백질을 합성한다는 점이다. 포밀메티오닌을 만드는 효소, 포밀메티오닐-트랜스퍼라제는 세포질에서 합성된 이후 미토콘드리아로 이동해 작용하는데, POSTECH-KIST 공동연구팀은 특정 환경 조건에서 포밀메티오닐-트랜스퍼라제가 미토콘드리아로 이동하지 못하고 세포질에 남아 포밀메티오닌을 이용한 단백질 합성을 촉발시킬 뿐만 아니라, 이때 생성된 포밀화된 단백질들을 직접 인식해서 제거하는 새로운 분해 경로가 존재한다는 것을 밝혔다. 이러한 합성법은 포밀메티오닌을 이용해 단백질을 만들어내는, 원핵생물의 단백질 합성법을 그대로 흉내내고 있는 것으로, 이는 극한 상황에서는 세포가 적응하고 저항성을 높이기 위해 아주 중요하다고 연구팀은 밝혔다. 연구를 주도한 POSTECH 황철상 교수는 “이번 연구는 지금까지 미스터리로 남아있던 포밀메티오닌의 숨겨진 생명현상을 최초로 밝혀낸 것으로 새로운 연구분야를 개척했다고 평가할 수 있다”며 “이 결과를 밝히는 데에만 5년이나 걸렸을 정도로 도전과 실패를 수없이 반복해야 했다”고 밝혔다. KIST의 이철주 책임연구원은 “수많은 종류의 단백질 중에서 아주 짧은 순간 미량으로 밖에 존재하지 않는 포밀메티오닌을 가진 단백질을 찾는 것이 중요했는데, 질량분석 기반의 N-말단 단백체 연구방법이 큰 역할을 했다”고 밝혔다. 이 연구는 삼성미래기술육성재단(황철상)과 한국연구재단의 바이오의료기술개발사업(이철주)의 지원을 받아 수행됐다. <그림설명> (그림1) 영양분 고갈이나 장기적인 저온상태 등 특정 스트레스 상황에 적응하고 생존하기 위해, 효모는 Gcn2 키나아제를 통해 포밀메티오닐-트랜스퍼라아제 (Fmt1)의 세포질 내에 축적시키는 동시에 효소 활성을 증가시킨다. 그 결과, Fmt1은 세포질에서 fMet-tRNAi를 급격히 생성함으로써, 리보솜들이 포밀메티오닌을 가지고 단백질 합성을 시작할 수 있도록 유도한다.
- 13
- 작성자테라그노시스연구단 이철주 박사팀
- 작성일2018.11.08
- 조회수11272
-
12
뇌졸중 이후, 초음파 자극을 가했더니 뇌신경 재활 가속화
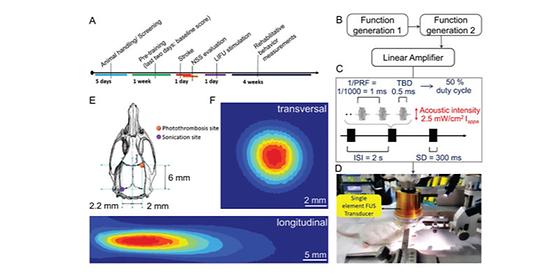
- 뇌졸중 동물의 소뇌를 초음파로 자극하여 편마비에 의한 운동장애 치료 - 뇌졸중에 따른 대뇌 손상을 보상할 수 있는 고해상도 뇌 자극 기술 개발 미국 신경재활학회 발표에 따르면 매년 전 세계 1500만 명이 뇌졸중을 겪고 있으며, 이로 인해 1/3은 사망에 이르고, 나머지 1/3은 영구적 장애를 가지고 평생을 살아가게 된다. 이처럼 뇌졸중으로 인한 후유증은 지속적으로 영향을 미치기 때문에 발생 후 조기 재활치료가 평생의 삶의 질을 좌우한다고 볼 수 있다. 뇌졸중의 경우 뇌를 지키는 보호막인 혈액-뇌 장벽(BBB, Blood-Brain Barrier)에 의해 약물이 뇌 조직으로 통과하지 못하는 문제점이 있어 이를 해결하기 위해 뇌의 다양한 자극 위치에 따른 재활 효과에 대한 연구가 국내외에서 활발하게 이루어지고 있다. 최근 국내 연구진이 저강도 집속초음파 기반의 고해상도 비침습 뇌자극 방법을 이용하여 뇌졸중 후 편마비에 의한 운동장애 재활치료를 가속시킬 수 있는 새로운 기술을 개발하여 관심을 모으고 있다. 한국과학기술연구원(KIST, 원장 이병권) 의공학연구소 바이오닉스연구단 김형민 박사팀은 저강도 집속초음파 뇌자극 기술을 이용하여 소뇌의 특정 영역의 신경활성을 조절하고, 이를 통해 뇌졸중에 의한 뇌신경 손상을 보상하고 편마비에 의한 운동장애를 치료할 수 있다는 것을 입증하였다. KIST 김형민 박사팀은 급성 뇌졸중의 경우에 병변 부위와 공간적으로는 떨어져 있으나 기능적으로 연결되어 있는 소뇌에서 이차적인 혈류 저하 및 대사저하가 관찰된다는 이전 연구들을 바탕으로 소뇌를 저강도 집속초음파를 이용해 비침습적으로 자극하여 위축된 기능적 회복을 돕고, 나아가 경색 부위로 연결되는 신경경로를 활성화 시킬 수 있도록 하였다. 또한 연구진은 실제 실험을 통해 뇌졸중 쥐 모델에 저강도 집속초음파로 소뇌를 자극하여 양쪽 앞다리에서 자극에 의한 움직임을 유발시키고, 운동전위를 검출하는 데 성공하였다. 또한 4주 동안 초음파 자극을 받은 실험군이 대조군에 비해 향상된 운동 능력을 유지하는 것을 관찰하였고, 이를 통해 뇌졸중에 의한 대뇌 손상 부위가 아닌 기능적으로 연결된 소뇌를 자극하여 뇌부종이 감소함을 확인하였다. 본 연구는 기존의 침습적인 방법을 통한 심부 자극의 한계를 극복하고, 이를 활용한 편마비에 의한 운동장애 치료 가능성을 열었다는 의의를 지닌다. 또한 기존의 비침습 뇌자극 방법이 자극 범위가 넓고 자극의 깊이가 뇌 피질에 국한되는 것과 달리, 이번 기술은 뇌심부 영역의 수 mm 이내의 국소적인 영역까지 선택적으로 자극할 수 있는 기술로서, 향후 뇌신경 재활에서 효과적인 치료기술 개발을 위한 다양한 응용 연구가 기대된다. KIST 김형민 박사는 “본 연구를 통해서 확인된 뇌신경 재활 효과가 사람에게 적용되기 위해서는 사람의 뇌졸중과 유사한 동물 모델을 통한 추가적인 검증이 필요하며, 초음파 뇌자극 기술의 안전성에 대해서도 장기적인 추적 연구가 이뤄져야한다.”라고 말하며, “환자의 뇌손상 정도와 손상위치 등의 다양성을 고려하여, 최적의 효과를 위한 장애 맞춤형 뇌자극 기술에 대한 추가적인 연구가 필요하다”고 밝혔다. 최근 KIST 바이오닉스연구단은 국가과학기술연구회의 지원을 받아 2018년도 창의형 융합연구사업(총 연구비 93억/5년)을 수주하였으며, 이번 연구결과를 바탕으로 환자맞춤형 뇌졸중 장애극복 기술 연구를 지속적으로 수행해나갈 계획이다. 본 연구는 과학기술정보통신부(장관 유영민) 지원으로 KIST 기관고유사업과 보건복지부(장관 박능후) 연구중심병원 육성 R&D 사업으로 수행되었으며, 연구결과는 재활 분야 최상위 국제학술지 ‘Neurorehabilitation and Neural Repair’ (IF : 4.711, JCR 분야 상위 0.769%) 최신호에 게재되었다. <그림설명> <그림 1> 뇌졸중 재활을 위한 소뇌 저강도 집속 초음파 자극 실험의 파라미터 및 자극 모식도
- 11
- 작성자바이오닉스연구단 김형민 박사팀
- 작성일2018.09.10
- 조회수12188
-
10
스스로 조립된 유전자 가위, 생체 내 전달되어 암 치료한다
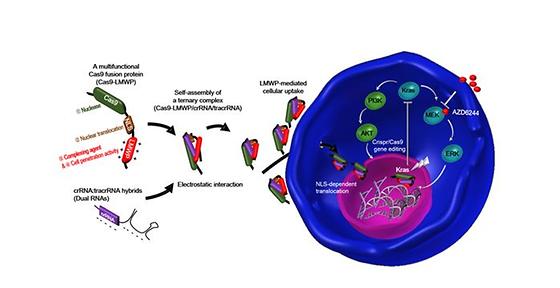
- 외부 전달체 필요없이 자가조립이 가능한 유전자 가위 시스템 기술 개발 - 생체 내(in-vivo) 전달가능 기술로 유전체 교정, 향후 암 표적 유전자 치료 기대 유전자 가위 기술은 특정 유전자를 제거하거나 정상적인 기능을 하도록 유전자를 편집함으로써, 질병의 근본적인 원인을 제거하여 치료할 수 있는 기술이다. 특히 유전자 가위 기술 중 3세대 크리스퍼 유전자 가위 기술*은 MIT Technology Review가 발표한 2014년 10대 혁신 기술, 2015년 세계경제포럼(WEF)에서 가장 주목 받는 10대 미래 기술로 선정되어 많은 주목을 받고 있다. 최근 국내 연구진이 유전자 절단 효소인 ‘Cas9’ 단백질을 개량하여 유전체 서열 선택성을 부여하는 ‘sgRNA’와 자가 조립이 가능하고, 외부의 전달체 없이 안전하게 암 생체 조직으로 전달 가능한 자가조립형 유전자 가위 시스템을 개발했다고 밝혔다. *크리스퍼 유전자가위(CRISPR-Cas9) 기술 : 세균의 면역반응에 관여하는 단백질에서 유래한 것으로, 유전자의 절단 기능을 가지는 Cas9 단백질과 유전체 서열 선택성을 부여하는 single guide RNA (sgRNA)가 동시에 작용하여 유전자를 선택적으로 교정하는 기술임. 한국과학기술연구원(KIST, 원장 이병권) 의공학연구소 생체재료연구단 오승자 박사팀과 테라그노시스연구단 장미희 박사팀은 공동연구를 통해 유전자 가위를 체내에 직접 넣는 `인비보(In-vivo)` 방식을 활용해 외부의 전달체 없이 자가조립이 가능하도록 유전자 교정 핵심 단백질(Cas9)을 개량, 안전성이 높고, 생체 조직 내의 표적이 용이하여 암을 치료할 수 있는 크리스퍼 유전자 가위 기술을 개발하였다. 기존의 유전자 가위를 생체 조직으로 전달하는 기술은 인지질로 구성된 양이온 리포좀(Cationic liposome)을 통한 전하 복합체의 형성에 의해 전달이 가능했기 때문에, 의도치 않은 면역원성을 유발하고 세포 독성이 높아, 임상 연구로 진행되기엔 한계가 있었다. 뿐만 아니라 양이온 리포좀내 유전자 가위를 캡슐화할 때 포착 효율이 좋지 않다는 단점을 가지고 있다. 그래서 이러한 유전자 가위를 통한 질병의 원인이 되는 DNA를 교정하는 기술이 유전자 치료제로 개발되기 위해서는, 유전자 가위가 생체 조직 안으로 면역 부작용이 없이 정확하고, 안전하게 표적하는 기술이 매우 중요하다고 여겨져왔다. KIST 오승자, 장미희 박사팀이 개발한 자가조립형 유전자 가위 기술은 외부의 전달체 없이 유전자 가위를 암 세포막 안으로 스스로 전달 가능하도록 하는 기술로, 핵까지 스스로 이동한 유전자 가위가 유전체를 교정하는 메커니즘을 가진다. KIST 연구진은 ‘Cas9’ 단백질의 서열 ‘C’ 말단 부위(c-terminus)를 음전하를 띄고 있는 sgRNA와 자가조립이 가능하도록 양전하로 구성된 자연 유래의 펩타이드 서열(LMWP, Low molecular weight protamine)과 핵으로 이동이 가능한 서열(NLS, Nuclear localization signal)을 가지도록 설계하였다. 특히, 양이온으로 구성된 자연 유래의 펩타이드 서열을 통해 음전하로 구성된 sgRNA와 자가 조립이 가능함과 동시에, 암 세포막을 통과 가능하게 설계하였다. 그 결과, 외부의 전달체 없이 손쉽게 자가조립이 가능한 유전자 전달 기술을 개발, 폐암치료에 적용하여 항암 효능 효과를 검증하였다. KIST 오승자 박사는 “이번 기술은 암을 포함한 난치성 유전 질환에 적용 가능한 플랫폼 기술로, 질병을 유발하는 유전자를 편집하여 교정하는 기술에 활용이 가능하다.”고 말했으며, KIST 장미희 박사는 “본 기술의 개발 이후에 지속적인 지원과 연구가 이어진다면, 동, 식물 개량 등 향후 유전자 조작이 필요한 전 분야에 응용 확장 가능한 기술로 발전 될 수 있다.” 고 밝혔다. 연구진은 향후 자가조립형 유전자 가위 기술을 치료제로 개발하기 위해 개발된 플랫폼의 안전성, 안정성, 재현성 등에 대한 데이터를 축적할 것을 우선과제로 꼽고 있다. 본 연구는 과학기술정보통신부(장관 유영민) 지원으로 KIST 기관고유사업으로 수행되었으며, 연구결과는 ‘ACS Nano’ (IF : 13.709, JCR 분야 상위 4.23%)에 최신호에 게재되었다. * (논문명) Simple in Vivo Gene Editing via Direct Self-Assembly of Cas9 Ribonucleoprotein Complexes For Cancer Treatment - (제1저자) 한국과학기술연구원 김승민 박사(박사후 연구원) - (교신저자) 한국과학기술연구원 오승자 선임연구원, 장미희 선임연구원 <그림설명> <그림 1> 자가조립형 유전자 가위 시스템 개발 및 이의 작동 원리
- 9
- 작성자생체재료연구단 오승자 박사팀, 테라그노시스연구단 장미희 박사팀
- 작성일2018.08.08
- 조회수14161